
用稀盐酸预处理强酸型阳离子交换树脂,使之转变为HR,并用蒸馏水洗涤至中性。然后,用该树脂软化100 mL含0.001 mol Mg2+的中性溶液,使Mg2+完全被树脂所交换,再用100 mL蒸馏水洗涤树脂。将交换液和洗涤液收集在一起,该混合液的pH为( )
科目:高中化学 来源: 题型:
 Ba2+(aq)+SO42-(aq)
Ba2+(aq)+SO42-(aq) Ba2+(aq)+SO42-(aq)
Ba2+(aq)+SO42-(aq)查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
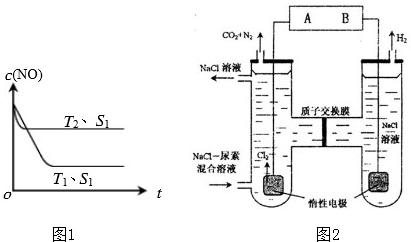 汽车尾气已成为重要的空气污染物.
汽车尾气已成为重要的空气污染物.| 实验组 | 温度℃ | 起始量/mol | 平衡量/mol | 达到平衡所需 时间/min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | d | t |
| a |
| b |
查看答案和解析>>
科目:高中化学 来源: 题型:

(1)若以A点表示
(2)将pH=8的Ba(OH)2溶液与pH=5的稀盐酸混合,并保持
(3)已知AnBm的离子积=[c(Am+)]n·[c(Bn-)]m,式中c(Am+)和c(Bn-)表示离子的物质的量浓度。在某温度下Ca(OH)2的溶解度为
查看答案和解析>>
科目:高中化学 来源:模拟题 题型:实验题
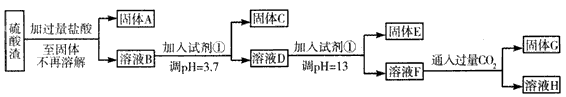
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com