
分析 根据常见化合物D2C2与水反应生成C的单质,且溶液使酚酞试液变红可知,C为O元素,D为Na元素;B的最外层电子数比C的最外层电子数少1个,则B的最外层电子数为5,与氧元素同周期,则B应为N元素;C与E同主族,E应为S元素,A与氧元素同周期,A与C的最外层电子数之比2:3,则A的最外层电子数为4,应为C元素,根据元素所在周期表中的位置结合元素周期律的递变规律以及对应化合物的结构和性质解答该题.
解答 解:(1)常见化合物D2C2与水反应生成C的单质,且溶液使酚酞试液变红,可知C为O元素,D为Na元素;B的最外层电子数比C的最外层电子数少1个,则B的最外层电子数为5,与氧元素同周期,则B应为N元素;C与E同主族,E应为S元素,A与氧元素同周期,A与C的最外层电子数之比2:3,则A的最外层电子数为4,应为C元素,
根据分析可知,A、B、C、D、E分别为:C、N、O、Na、S,
故答案为:C;N;O;Na;S;
(2)E为S元素,原子序数为16,核外有3个电子层,最外层电子数为6,位于周期表第三周期VIA族,
故答案为:三;VIA;
(3)B为N元素,其氢化物为氨气,其最高价氧化物的水化物为硝酸,氨气与硝酸反应生成NH4N03,
故答案为:NH4N03;
(4)化合物D2C2为过氧化钠,过氧化钠与水反应生成氢氧化钠和氧气,反应的化学方程式为:2Na2O2+2H2O=4NaOH+O2↑,
故答案为:2Na2O2+2H2O=4NaOH+O2↑;
(5)浓硝酸跟铜反应生成硝酸铜、二氧化碳与水,反应离子方程式:Cu+4H++2NO3-=Cu2++2NO2↑+2H2O,
故答案为:Cu+4H++2NO3-=Cu2++2NO2↑+2H2O.
点评 本题考查结构性质位置关系、氮氧元素化合物性质等,题目难度中等,推断元素是解题关键,过氧化钠的性质是解答本题的突破口,注意基础知识的理解掌握.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3-CH═CH2与 | B. | 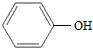 与 与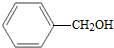 | ||
| C. | CH3COOCH3与CH3CH2COOCH3 | D. | CH3CH2Cl与CH3CHCl-CH2Cl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原予序数:W>X>Y>Z | |
| B. | 原子半径:r(W)>r(X)>r(Y)>r(Z) | |
| C. | 最高价氧化物对应的水化物碱性:w<x | |
| D. | 在电解过程中,W3XZ6的主要作用是增强电解质的导电性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 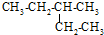 2-乙基丁烷 2-乙基丁烷 | B. | CH2=CHCH2CH3 丁烯 | ||
| C. | 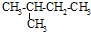 异戊烷 异戊烷 | D. | 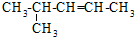 4-甲基-2-戊烯 4-甲基-2-戊烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 其中B、C的相对分子质量相等,则A的可能的结构简式有( )
其中B、C的相对分子质量相等,则A的可能的结构简式有( )| A. | 9种 | B. | 8种 | C. | 7种 | D. | 6种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同一元素不可能既表现金属性,又表现非金属性 | |
| B. | 由长、短周期元素共同组成的元素族称为主族 (除零族外) | |
| C. | 短周期元素原子形成简单离子后,最外层电子都达到8电子稳定结构 | |
| D. | 互为同位素的不同核素,物理性质和化学性质都不同 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com