
卤族元素随着原子序数的增大,下列递变规律正确的是( )
| A.原子半径逐渐增大 | B.单质的氧化性逐渐增强 |
| C.单质熔、沸点逐渐降低 | D.气态氢化物稳定性逐渐增强 |
科目:高中化学 来源: 题型:单选题
下列有关电负性的说法中正确的是( )
| A.主族元素的电负性越大,元素原子的第一电离能一定越大 |
| B.在元素周期表中,元素电负性从左到右越来越大 |
| C.金属元素电负性一定小于非金属元素电负性 |
| D.在形成化合物时,电负性越小的元素越容易显示正价 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
X、Y、Z为短周期元素,原子序数依次增大。X原子的最外层电子数是Y原子最外层电子数的2倍,质子数比Y少5,X和Z在同一主族。下列叙述不正确的是( )
| A.原子半径:Y>Z |
| B.X元素的一种单质可用于消毒杀菌 |
| C.Y的氧化物是工业制取Y单质的主要原料 |
| D.Z的单质在氧气中点燃可生成两种酸性氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
同族元素所形成的同一类型的化合物,其结构和性质往往相似。化合物PH4I是一种白色晶体,已知HI受热易分解成H2和I2。下列对它的描述中正确的是( )
| A.它是一种共价化合物 |
| B.在加热时此化合物只分解为PH3和HI |
| C.这种化合物不能跟碱反应 |
| D.该化合物可以由PH3和HI化合而成 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
英国化学家戴维(Davy)用电解法成功地制出了金属钾和钠。他临终前在医院养病期间,一位朋友去看他,问他一生中最伟大的发现是什么,他绝口未提自己发现的众多化学元素中的任何一个,却说:“我最大的发现是一个人——法拉第!”钠(Na)在周期表中的位置是
| A.第二周期第IA族 | B.第二周期第IIA族 |
| C.第三周期第IA族 | D.第三周期第IIA族 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(10分)下表是元素周期表的一部分,请针对表中所列标号为①~⑩的元素回答下列问题。
 族 族周期 | IA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 二 | | | | ① | ② | ③ | ④ | |
| 三 | ⑤ | ⑥ | ⑦ | | | ⑧ | ⑨ | ⑩ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(9分)下表为元素周期表的一部分,请参照元素①~⑧在表中的位置,用化学用语回答下列
问题: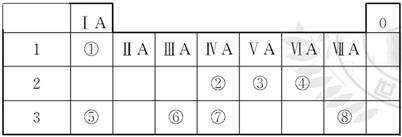
(1)④、⑤、⑥的原子半径由大到小的顺序是____________。
(2)②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是____________。
(3)①、④、⑤、⑧中的某些元素可形成既含离子键又含极性共价键的化合物,写出其中一种化合物的电子式:_____________________________________。
(4)由表中两种元素的原子按1∶1组成的常见液态化合物的稀溶液易被催化分解,可使用的催化剂为(填序号)_______________________________________。
a.MnO2 b.FeCl3 c.Na2SO3 d.KMnO4
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(6分)下表为元素周期表的一部分,期中的编号代表对应的元素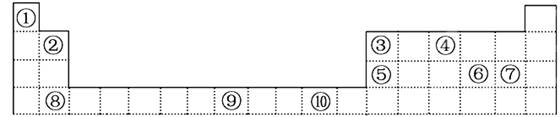
请回答下列问题:
(1)表中属于ds区的元素是________(填编号)。
(2)写出元素⑨的高价离子的电子排布式_____________________________。
(3)某元素的最外层电子排布式为nsnnpn+1,该元素原子的核外共有________种不同运动状态的电子。该元素在周期表中的位置是上表中相对应的 (填编号),该元素的气态氢化物沸点较高的原因是
(4)⑥、⑦分别①形成的化合物稳定性较强的为 (化学式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
碱金属元素在科学研究与生产生活中有着非常广泛的用途。
(1)锂是最轻的金属,如果用锂做一架飞机,两个人就可以抬动。锂在元素周期表中的表示如图所示,填写以下空格。
①Li在元素周期表中的位置: 。
②6.941的意义: __________________________。
(2)光电管是利用碱金属铯受到光照射时能形成电流这一光电效应的性质制成的。
①完成铯的原子结构示意图: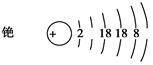
②下列有关铯的说法正确的是________。
| A.其单质在常温下与水反应不如钠剧烈, | B.其原子半径比钾原子半径小 |
| C.其氢氧化物的水溶液不能使氢氧化铝溶解, | D.其碳酸盐易溶于水 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com