
分析 (1)依据元素化合价分析物质具有的氧化性还原性判断,元素化合价最高价具有氧化性,最低价具有还原性,据中间价态既具有氧化性又具有还原性;
(2)①在0.1mol•L-1FeCl2溶液滴入新制氯水,探究Fe2+的还原性,依据氯水中的氯气具有强氧化性能氧化亚铁离子,溶液由浅绿色变为黄色;
②验证三价铁离子的方法是硫氰酸钾溶液遇铁离子变血红色判断;
③氧化还原反应中还原剂的还原性大于还原产物分析判断.
解答 解:(1)元素化合价处于最高价只具有氧化性,处于最低价只具有还原性,处于中间价态既可以升高也可以降低,既具有氧化性又具有还原性;
故答案为:因为Fe2+中铁元素化合价处于中间价态,可以升高也可以降低;
(2)①在0.1mol•L-1FeCl2溶液滴入新制氯水,氯气具有强氧化性能源和亚铁离子为铁离子,反应的离子方程式为:Cl2+2Fe2+=2Cl-+2Fe3+;
溶液颜色从浅绿色变为黄色;
故答案为:Cl2+2Fe2+=2Cl-+2Fe3+;黄;
②通过检验Fe2+被氧化的产物Fe3+的存在以获取证据.需要的试剂为硫氰酸钾溶液,发生反应,Fe3++3SCN-=Fe(SCN)3,溶液变血红色,
故答案为:硫氰酸钾溶液;血红;
③金属单质都具有还原性,分别将铜片、锌粒投入FeCl2溶液中,结果铜片没变化,锌粒逐渐变小,发生反应Zn+Fe2+=Fe+Zn2+;氧化还原反应中还原剂的还原性大于还原产物,锌的还原性大于铁,铁大于铜,故答案为:Zn Fe Cu.
点评 本题考查了元素化合价变化与氧化性还原性的关系判断,铁及其化合物性质的应用,离子检验的方法应用,氧化还原反应概念的分析判断,题目较简单.


科目:高中化学 来源: 题型:选择题
| A. | 加成反应,消去反应,取代反应 | B. | 消去反应,加成反应,取代反应 | ||
| C. | 取代反应,消去反应,加成反应 | D. | 取代反应,加成反应,消去反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验 编号 | 室温下,试管中所加试剂及用量/mL | 室温下,溶液褪至无色所需时间/min | |||
| 0.6mol/L H2C2O4溶液 | H2O | 0.2mol/L KMnO4溶液 | 3mol/L H2SO4溶液 | ||
| 1 | 3.0 | 2.0 | 3.0 | 2.0 | 4.0 |
| 2 | 3.0 | 3.0 | 2.0 | 2.0 | 5.2 |
| 3 | 3.0 | 4.0 | 1.0 | 2.0 | 6.4 |
| 实验 编号 | 室温下,试管中所加试剂及用量/mL | 再向试管中加入少量固体 | 室温下,溶液褪至无色所需时间/min | |||
| 0.6mol/L H2C2O4溶液 | H2O | 0.2mol/L KMnO4溶液 | 3mol/L H2SO4溶液 | |||
| 4 | 3.0 | 2.0 | 3.0 | 2.0 | t | |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 乙二醛电解氧化制备乙醛酸(OHC-COOH)的生产装置如图所示,通电后,阳极产生的Cl2与乙二醛溶液反应生成乙醛酸.
乙二醛电解氧化制备乙醛酸(OHC-COOH)的生产装置如图所示,通电后,阳极产生的Cl2与乙二醛溶液反应生成乙醛酸.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
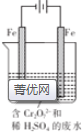 铬是极硬的银白色金属,主要用于冶炼各种合金钢和电镀.已知铬在自然界最重要的矿物是铬铁矿[Fe(CrO2)2或FeO.Cr2O3],工业上制备较纯的金属铬的方法常用铝热法,其中一种简要流程.
铬是极硬的银白色金属,主要用于冶炼各种合金钢和电镀.已知铬在自然界最重要的矿物是铬铁矿[Fe(CrO2)2或FeO.Cr2O3],工业上制备较纯的金属铬的方法常用铝热法,其中一种简要流程.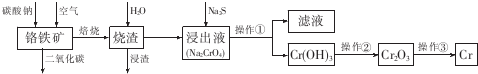
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
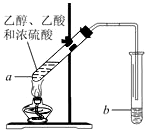 如图,在左试管中先加入3mL的乙醇,并在摇动下缓缓加入2mL浓硫酸,再加入2mL乙酸,充分摇匀.在右试管中加入5mL饱和Na2CO3溶液.按图连接好装置,用酒精灯缓慢加热.
如图,在左试管中先加入3mL的乙醇,并在摇动下缓缓加入2mL浓硫酸,再加入2mL乙酸,充分摇匀.在右试管中加入5mL饱和Na2CO3溶液.按图连接好装置,用酒精灯缓慢加热. CH3COOCH2CH3+H2O;
CH3COOCH2CH3+H2O;查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com