
分析 (1)25℃时,NH3•H2O电离出NH4+和OH-而导致溶液显碱性;
(2)醋酸是弱酸,在溶液中部分电离;
(3)碱在溶液中电离出氢氧根离子,会抑制水的电离;
(4)NaOH与醋酸等物质的量反应生成CH3COONa,醋酸根离子水解显碱性.
解答 解:(1)25℃时,NH3•H2O电离出NH4+和OH-而导致溶液显碱性,所以溶液中c(H+)<c(OH-);
故答案为:<;
(2)醋酸是弱酸,在溶液中部分电离,其电离方程式为:CH3COOH?CH3COO-+H+;
故答案为:CH3COOH?CH3COO-+H+;
(3)氨水在溶液中电离出氢氧根离子,即NH3•H2O?NH4++OH-,水的电离方程式为H2O?H++OH-,氨水电离出的OH-浓度使得水的电离平衡向左移动;
故答案为:抑制水的电离;NH3•H2O?NH4++OH-,H2O?H++OH-,氨水电离出的OH-浓度使得水的电离平衡向左移动;
(4)溶液②和溶液③等体积混合,NaOH与醋酸恰好按照等物质的量反应生成CH3COONa,醋酸根离子水解显碱性,即CH3COO-+H2O?CH3COOH+OH-;
故答案为:两溶液等体积混合得到CH3COONa 溶液,CH3COO-+H2O?CH3COOH+OH-.
点评 本题考查较为综合,涉及弱电解的电离、盐类的水解以及离子浓度大小比较等问题,侧重于学生的分析能力的考查,注意把握盐类水解原理和影响因素,难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 氯气和水发生反应:Cl2+H2O?2H++Cl-+ClO- | |
| B. | 金属钠和水反应:Na+2H2O═Na++2OH-+H2↑ | |
| C. | 用氢氧化钠除去铝表面的氧化膜时产生气泡的反应2Al+2OH-+6H2O═2[Al(OH)4]-+3H2↑ | |
| D. | 将金属铁加入稀硫酸和硝酸钾混合溶液中,金属溶解:Fe+2H+═Fe2++H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1L 1mol•L-1的NaClO溶液含有ClO-的数目为NA | |
| B. | 22.4 L Cl2分别与足量的Cu、Fe完全反应转移电子数分别为2NA、3NA | |
| C. | 常温常压下,14g由N2和CO组成的混合气体含有的电子总数为7NA | |
| D. | 14.2g硫酸钠固体含有0.l NA个硫酸钠分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
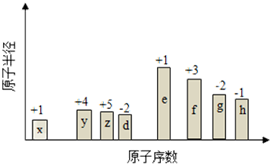 随原子序数的递增,八种短周期元素(用字母表示)原子半径的相对大小、最高正价或 最低负价的变化如图所示. 根据判断出的元素回答问题:
随原子序数的递增,八种短周期元素(用字母表示)原子半径的相对大小、最高正价或 最低负价的变化如图所示. 根据判断出的元素回答问题: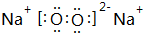 ,0.10mol该化合物与足量水反应时转移的电子数为6.02×1022.
,0.10mol该化合物与足量水反应时转移的电子数为6.02×1022.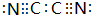 ,(yz)2称为拟卤素,性质与卤素类似,其与氢氧化钠溶液反应的化学方程式是(CN)2+2NaOH=NaCN+NaCNO+H2O.
,(yz)2称为拟卤素,性质与卤素类似,其与氢氧化钠溶液反应的化学方程式是(CN)2+2NaOH=NaCN+NaCNO+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | A溶液中的c(OH-)是B溶液中的c(OH-)的α1倍 | |
| B. | α1>α2 | |
| C. | B溶液的物质的量浓度可表示为$\frac{c}{{α}_{2}}$mol•L-1 | |
| D. | pH:溶液A>溶液B |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ⑤⑥ | B. | ②③④⑤ | C. | ③⑤ | D. | ①③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com