
| A. | 少量酒精在空气中挥发不见了;少量酒精在空气中燃烧后消失 | |
| B. | 块状生石灰在空气中逐渐变成粉末;晶体碳酸钠在空气中逐渐变成粉末 | |
| C. | 木炭燃烧发光、发热;电灯发光、发热 | |
| D. | 石灰水中通入少量CO2后变浑浊;室温下的饱和石灰水加热后变浑浊 |
分析 判断一个变化是物理变化还是化学变化,要依据在变化过程中有没有生成其他物质,生成其他物质的是化学变化,没有生成其他物质的是物理变化.
解答 解:A.少量酒精在空气中燃烧能生成水和二氧化碳,属于化学变化,少量酒精在空气中挥发的过程中属于酒精从液态变为气态,没有新物质生成,属于物理变化,故A错误;
B.块状生石灰在空气中逐渐变为白色粉末的过程中能生成氢氧化钙,属于化学变化,晶体碳酸钠在空气中逐渐变成粉末为十水合碳酸钠分解生成粉状碳酸钠和水,属于化学变化,故B正确;
C.木炭在空气中燃烧能生成二氧化碳,属于化学变化;灯泡通电,发光、放热的过程中没有新物质生成,属于物理变化.故C错误;
D.澄清石灰水中通入适量二氧化碳能生成碳酸钙和水,属于化学变化;氢氧化钙溶解度随着温度的升高而降低,澄清的饱和石灰水加热升温后变浑浊是溶解度降低析出溶质,该过程中没有新物质生成,属于物理变化,故D错误;
故选B.
点评 本题考查化学变化和物理变化的区别,解答本题要分析变化过程中是否有新物质生成,如果没有新物质生成就属于物理变化,如果有新物质生成就属于化学变化,题目较简单.一般地,物理变化有物质的固、液、气三态变化和物质形状的变化.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
温度/℃ 化合物 | 0 | 20 | 40 | 60 | 80 | 100 |
| NH4Cl | 29.3 | 37.2 | 45.8 | 55.3 | 65.6 | 77.3 |
| ZnCl2 | 343 | 395 | 452 | 488 | 541 | 614 |
| 化合物 | Zn(OH)2 | Fe(OH)2 | Fe(OH)3 |
| Ksp近似值 | 10-17 | 10-17 | 10-39 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol羟基中电子数为10NA | |
| B. | 常温下,1L 0.1mol/L的NH4NO3的溶液中氮原子数为0.2NA | |
| C. | 在反应KIO3+6HI=KI+3 I2+3 H2O中,每生成3mol I2转移的电子数为6NA | |
| D. | 常温常压下,22.4L乙烯中C-H键数为4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 因SiO2不溶于水,故SiO2不是酸性氧化物 | |
| B. | 在反应SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑中SiO2作氧化剂 | |
| C. | SiO2是一种空间立体网状结构的晶体,熔点高、硬度大 | |
| D. | 氢氟酸能够刻蚀玻璃,故不能用玻璃瓶来盛装氢氟酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
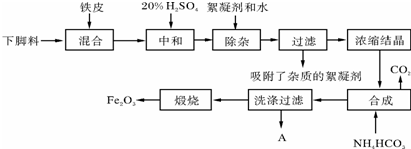
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
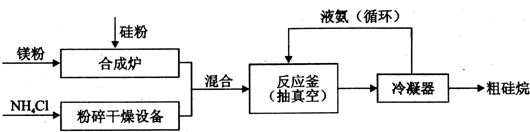
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属钠加入无水乙醇中:Na+C2H5OH→C2H5ONa+H2↑ | |
| B. | 过量的乙酸跟Na2CO3溶液反应:2H++CO32-═H2O+CO2↑ | |
| C. | 溴乙烷在NaOH水溶液中加热:CH3CH2Br+NaOH→CH2═CH2↑+NaBr+H2O | |
| D. | 苯酚钠溶液中通入CO2: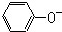 +CO2+H2O→ +CO2+H2O→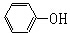 +HCO${\;}_{3}^{-}$ +HCO${\;}_{3}^{-}$ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com