

| ��ѧ�� | H-H | C-O | C��O | H-O | C-H |
| E/��kJ•mol-1�� | 436 | 343 | 1076 | 465 | x |
| T��K�� | ���� | CO2ת���ʣ�%�� | �״�ѡ���ԣ�%�� |
| 543 | Cat.1 | 12.3 | 42.3 |
| 543 | Cat.2 | 10.9 | 72.7 |
���� ��1��I��CO2��g��+3H2��g��?CH3OH��g��+H2O��g����H1=-58.0kJ•mol-1����Ӧ�Ƿ��ȷ�Ӧ��II��CO2��g��+H2��g��?CO��g��+H2O��g����H2=+41.0kJ•mol-1�����ȷ�Ӧ��
��2���¶�����ƽ�������ȷ�Ӧ������У���ӦIIΪ���ȷ�Ӧ������ƽ��������У�ƽ�ⳣ������
��3���ٽ���Ȼ�ѧ����ʽ����õ�һ����̼��������Ӧ���ɼ״����Ȼ�ѧ����ʽ����Ӧ��=��Ӧ���ܼ���-�������ܼ��ܣ�
�����¶�Tʱ����ʼ$\frac{n��CO��}{n��{H}_{2}��}$=$\frac{1}{2}$��������ƽ��ʱ��CO��ת����Ϊ50%��������м���õ�ƽ�����ʵ�������ƽ���ѹ����ƽ��Ũ�ȼ��㣬��ѹ=��ѹ�����ʵ���������
��4������CO2��g��+3H2��g��?CH3OH��g��+H2O��g����H1=-53.7kJ•mol-8 ��֪���CO2ת��ΪCH3OHƽ��ת���ʣ�Ӧʹƽ���������ƶ����ɽ����¶ȣ�����Ũ�ȣ�
�ڼ���������ɽ��ͷ�Ӧ�Ļ�ܣ�������Խǿ�����Խ�ͣ�����Ӧ�Ȳ��䣮
��� �⣺��1��I��CO2��g��+3H2��g��?CH3OH��g��+H2O��g����H1=-58.0kJ•mol-1����Ӧ�Ƿ��ȷ�Ӧ��II��CO2��g��+H2��g��?CO��g��+H2O��g����H2=+41.0kJ•mol-1�����ȷ�Ӧ����Ӧ���ڷ�Ӧ�����зų���������Ӧ��ϵ�¶����߷�Ӧ��������Ӧ�������ȷ�Ӧ���ڷ�Ӧ�������¶Ƚ��ͣ��¶Ƚ��ͷ�Ӧ���ʼ�������������������Ӧ�У�������ѧ�����ƽϴ���Ǣ�
�ʴ�Ϊ��I��
��2��II��CO2��g��+H2��g��?CO��g��+H2O��g����H2=+41.0kJ•mol-1�����ȷ�Ӧ������ƽ��������У�ƽ�ⳣ������ͼ1�б�ʾ��ӦIIƽ�ⳣ��K���¶ȱ仯��ϵ������Ϊb��
�ʴ�Ϊ��b����ӦIIΪ���ȷ�Ӧ�������¶ȣ�ƽ�������ƶ���ƽ�ⳣ������
��3����I��CO2��g��+3H2��g��?CH3OH��g��+H2O��g����H1=-58.0kJ•mol-1
II��CO2��g��+H2��g��?CO��g��+H2O��g����H2=+41.0kJ•mol-1
��˹���ɼ���õ�����-��õ�CO��g��+2H2��g��?CH3OH��g����H=-99KJ/mol��
��Ӧ��=��Ӧ���ܼ���-�������ܼ���=��1076+2��436-3��x-343-465��KJ/mol=-99KJ/mol��
x=431KJ/mol��
�ʴ�Ϊ��413��
�����¶�Tʱ����ʼ$\frac{n��CO��}{n��{H}_{2}��}$=$\frac{1}{2}$�������ʵ���Ϊ1mol��2mol��������ƽ��ʱ��CO��ת����Ϊ50%��
CO��g��+2H2��g��?CH3OH��g����
��ʼ����mol�� 1 2 0
�仯����mol�� 0.5 1 0.5
ƽ������mol��0.5 1 0.5
���������ʵ���=0.5mol+1mol+0.5mol=2mol
Kp=$\frac{\frac{0.5}{2}��pMp}{\frac{0.5}{2}��pMp����\frac{1}{2}��pMp��^{2}}$=$\frac{4}{{p}^{2}}$��MPa��-2 ��
�ʴ�Ϊ��$\frac{4}{{p}^{2}}$��MPa��-2 ��
��4����A��ʹ�ô���Cat.1��ƽ�ⲻ�ƶ����������ת���ʣ���A����
B������ CO2��H2�ij�ʼͶ�ϱȣ�������������ת���ʣ�������̼��ת���ʼ�С����B����
C��ʹ�ô���Cat.2���������ת���ʣ���C����
D��Ͷ�ϱȲ��䣬���ӷ�Ӧ���Ũ�ȣ��������ƶ���������ת���ʣ���D��ȷ��
�ʴ�Ϊ��D��
�ڴӱ������ݷ������ڴ���Cat.2�������£��״���ѡ���Ը���˵������Cat.2�Է�Ӧ���Ч�����ã������ܽ��ͷ�Ӧ�Ļ�ܣ�˵��ʹ�ô���Cat.2�ķ�Ӧ�����л�ܸ��ͣ���ͼΪ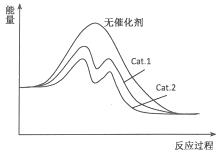 ��
��
�ʴ�Ϊ�� ��
��
���� ���⿼���Ϊ�ۺϣ��漰��ѧƽ��ļ��㣬ƽ���ƶ��Լ��Ȼ�ѧ����ʽ���绯ѧ��֪ʶ��Ϊ�߿��������ͣ�������ѧ���ķ������������������Ŀ��飬ע����ո�˹���ɵ�Ӧ�ã����صĹ���ԭ����֪ʶ����Ŀ�Ѷ��еȣ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��ɫ��ѧ�ĺ����ǶԻ�����Ⱦ�����ۺ����� | |
| B�� | Al2O3�������ͻ���� | |
| C�� | �ع��;������������ȼ���� | |
| D�� | �������Һ�ı��������Ƿ�ɢ������ֱ����С |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����


�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������


�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ����Խ�ȶ������۷е�Խ�� | |
| B�� | HF�����ȶ��Ժܺã�����ΪHF���Ӽ������� | |
| C�� | ���ȷ�Ӧ������Ҫ���ȾͿ��Խ��� | |
| D�� | ���ȷ�Ӧ��һ����Ҫ�������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �۲���ɫ | B�� | �����ᷴӦ | C�� | �����ᷴӦ | D�� | ���ܶ� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com