
| A. | ①③ | B. | ①④ | C. | ②④ | D. | ③④ |
分析 ①酸性氧化物是能和碱反应生成盐和水的氧化物;
②氧化物分为酸性氧化物、碱性氧化物和不成盐氧化物和两性氧化物等;
③碱性氧化物即能和酸反应生成盐和水的氧化物;
④分散系是将一种或几种物质分散到另一种或几种物质中形成的体系.
解答 解:①酸性氧化物是能和碱反应生成盐和水的氧化物,但不一定为非金属氧化物,故Mn2O7,是酸性氧化物但是金属氧化物,故①错误;
②氧化物分为酸性氧化物、碱性氧化物和不成盐氧化物和两性氧化物等,故不能和酸反应的氧化物也不一定能跟碱反应,如不成盐氧化物,故②错误;
③碱性氧化物即能和酸反应生成盐和水的氧化物,一定是金属氧化物,故③正确;
④分散系是将一种或几种物质分散到另一种或几种物质中形成的体系,故一定是混合物,故④正确;
故选D.
点评 本题考查了氧化物的概念及其联系,题目难度不大,但概念间的联系是学习的难点,属于易错题.


 浙江名校名师金卷系列答案
浙江名校名师金卷系列答案 全优冲刺100分系列答案
全优冲刺100分系列答案科目:高中化学 来源: 题型:解答题
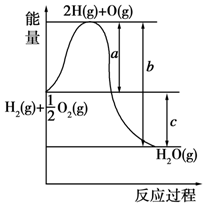 已知:H2(g)+$\frac{1}{2}$O2(g)═H2O(g),反应过程中能量变化如图所示,请回答下列问题.
已知:H2(g)+$\frac{1}{2}$O2(g)═H2O(g),反应过程中能量变化如图所示,请回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.8mol/L | B. | 1.6mol/L | C. | 0.9mol/L | D. | 1.8mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
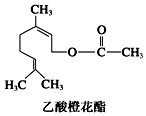
| A. | 分子式为C12H20O2 | |
| B. | 1 mol该有机物水解时只能消耗1 mol NaOH | |
| C. | 1mol该有机物可消耗3molH2 | |
| D. | 不能发生银镜反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4L水中含有NA个水分子 | |
| B. | 常温常压下,28gCO中所含的原子数目为2NA | |
| C. | 如果11.2LN2中含有n个分子,则阿伏加德罗常数一定为2n | |
| D. | 1L 1mo1/L的NaHSO4溶液中,HSO4-离子的数目为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,16g甲烷所含原子数为4NA | |
| B. | 标准状况下,2.24LCH4和NH3混合气气体中含有的电子数目为NA | |
| C. | 标准状况下,11.2L的HCl溶于1.0L的水中,所得溶液中HCl的浓度为0.5mol/L | |
| D. | 常温下,5.6克铁与足量的盐酸反应,失去的电子数为0.2mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源:2016-2017学年宁夏卫一高一上10月月考化学a卷(解析版) 题型:填空题
现有mg某气体,它由双原子分子构成,它的摩尔质量为Mg/mol。若阿伏加德罗常数用NA表示,则:
(1)该气体的物质的量为__________mol
(2)该气体所含原子总数为______________。
(3)该气体在标准状况下的体积为________L
(4)该气体溶于1ml水中(不考虑反应),设溶液的密度为ρg/cm3,则该溶液的物质的量浓度为_______mol· L-1。
(5)该气体溶于水后形成VL溶液,其溶液的物质的量浓度为__________mol·L-1。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年安徽师大附中高二上10月月考化学卷(解析版) 题型:选择题
下列有关的判断或表示方法正确的是
A.一定条件下,将0.5 mol N2(g)和1.5 mol H2(g)置于密闭的容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为:N2(g)+3H2(g) 2NH3(g) ΔH<-38.6 kJ·mol-1
2NH3(g) ΔH<-38.6 kJ·mol-1
B.中和热的测定实验中需要用的主要玻璃仪器:两个大小相同的烧杯、两个大小相同的量筒、温度计、环形玻璃搅拌棒,也可以用保温杯代替烧杯做有关中和热测定的实验。
C.在测定中和热的实验中,至少需要测定并记录的温度是3次
D.CO(g)的燃烧热是283.0 kJ·mol-1,则CO2分解的热化学方程式为:2CO2(g)===2CO(g)+O2(g) ΔH=+283.0 kJ·mol-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com