
【题目】下列关于“同位素”、“同素异形体”、“同系物”、“同分异构体”的说法合理的是 ( )
A. 同位素是指质量数相同,中子数不同的同种元素的不同原子
B. 同素异形体是指由同种元素形成的不同单质
C. 互为同分异构体的两种物质分子式相同,化学性质一定相似
D. 具有相同的通式,组成上相差若干个“![]() ”原子团的有机物一定互为同系物
”原子团的有机物一定互为同系物
 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:
【题目】氢元素与其他元素形成的化合物称为氢化物,下列有关氢化物的叙述不正确的是
A. D2O分子的空间构型为直线形B. NH3的结构式为![]()
C. HCl分子中含有3个孤电子对D. H2S和H2O分子的中心原子都采用sp3杂化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(2017·天津卷)常压下羰基化法精炼镍的原理为:Ni(s)+4CO(g)![]() Ni(CO)4(g)。230℃时,该反应的平衡常数K=2×105。已知:Ni(CO)4的沸点为42.2℃,固体杂质不参与反应。
Ni(CO)4(g)。230℃时,该反应的平衡常数K=2×105。已知:Ni(CO)4的沸点为42.2℃,固体杂质不参与反应。
第一阶段:将粗镍与CO反应转化成气态Ni(CO)4;
第二阶段:将第一阶段反应后的气体分离出来,加热至230℃制得高纯镍。
下列判断正确的是
A. 增加c(CO),平衡向正向移动,反应的平衡常数增大
B. 第二阶段,Ni(CO)4分解率较低
C. 第一阶段,在30℃和50℃两者之间选择反应温度,选50℃
D. 该反应达到平衡时,v生成[Ni(CO)4]=4v生成(CO)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向浓度相等、体积均为100 mL的A、B两份NaOH溶液中,分别通入一定量的CO2后,逐滴加入0.1 mol/L的盐酸,产生CO2的体积(标准状况)与所加盐酸的体积关系如图所示。
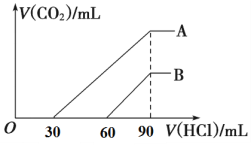
(1)A曲线表明,原溶液通入CO2 ________mL(标准状况)。
(2)B曲线表明,原溶液通入CO2后,所得溶液中溶质的物质的量之比为__________。
(3)原NaOH溶液的物质的量浓度为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为测定某氟化稀土样品中氟元素的质量分数进行如下实验。利用高氯酸(高沸点酸)将样品中的氟元素转化为氟化氢(低沸点酸)蒸出,再通过滴定测量,实验装置如图所示。

(1)c的名称是________________
(2)检查装置气密性:在b和f中加水,水浸没导管a和e末端,______________(填操作步骤),微热c,容量瓶f有气泡冒出,导管a内形成一段水柱;停止加热,_________________________,说明装置气密性良好。
(3)c中加入一定体积高氯酸和m g氟化稀土样品,f中盛有滴加酚酞的NaOH溶液。加热b、c,使水蒸气进入c。
①向c中通水蒸气的目的是________________________________;
②c中除有HF气体外,可能还有少量SiF4(易水解)气体生成,若有SiF4生成,实验结果将__________(填“偏高”“偏低”或”不受影响”)。
③若观察到f中溶液红色褪去,需要向f中及时补加NaOH溶液,否则会使实验结果偏低,原因_______________________________。
(4)向馏出液中加入V1ml c1 mol·L-1La(NO3)3溶液,得到LaF3沉淀,再用c2 mol·L-1 EDTA标准溶液滴定剩余的La3+(La3+与EDTA按1:1络合),消耗EDTA标准溶液V2 mL,则氟化稀土样品中氟的质量分数为____________(写出表达式即可,不需化简)。
(5)用样品进行实验前,需要用0.084g氟化钠代替样品进行实验,改变条件(高氯酸用量、反应温度、蒸馏实验),测量并计算出氟元素质量,重复多次。该操作的目的是_________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于烷烃性质的叙述错误的是 ( )
A. 标准状况下,气态烷烃的密度不可能大于3g/L
B. 常温常压下,碳原子相同的液态烷烃,至少含3种结构
C. 室温下,固态烷烃的密度都小于水,会浮在水面上
D. 烷烃的热稳定性都较差,受热一定会分解成C和![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素周期表是学习化学的重要工具。回答下列问题:
(1)硅元素最外层有______种能量不同的电子,有______种运动状态不同的电子,写出其最外层电子的电子排布式__________________。
(2)![]() 的空间构型和
的空间构型和![]() 相同,写出
相同,写出![]() 的电子式:__________________。
的电子式:__________________。
(3)部分短周期元素化合价与原子序数的关系可用图示表示。
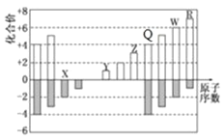
①元素X在元素周期表中的位置是__________________。
②写出元素Y和Z的最高价氧化物对应水化物反应的离子方程式:______________________________。
③第三周期主族元素中非金属性最强的两种元素是____________和____________(填元素符号),用一个化学方程式说明这两种元素非金属性的相对强弱:______________________________。
(4)第三同期元素的原子所形成的简单离子中:还原性最弱的阴离子是____________;氧化性最强的阳离子是____________。
(5)写出两种W的含氧酸的化学式____________、____________,设计一种实验方案比较两种酸的酸性强弱,写出反应的化学方程式:________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水热法制备Fe3O4纳米颗粒的总反应为:3Fe2++2S2O32-+O2+4OH-=Fe3O4+S4O62-+2H2O,下列说法正确的是
A. O2和S2O32-是氧化剂,Fe2+是还原剂
B. 每生成1mol Fe3O4,则转移电子为2mol
C. 参加反应的氧化剂与还原剂的物质的量之比为1:1
D. 若有2mol Fe2+被氧化,则被Fe2+还原的O2为0.5mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】醋酸亚铬水合物[Cr(CH3COO)2]2·2H2O(摩尔质量376g/mol)是一种氧气吸收剂,红棕色晶体,易被氧化;易溶于盐酸,微溶于乙醇,难溶于水和乙醚。其制备装置(已省略加热及支持装置)和步骤如下:
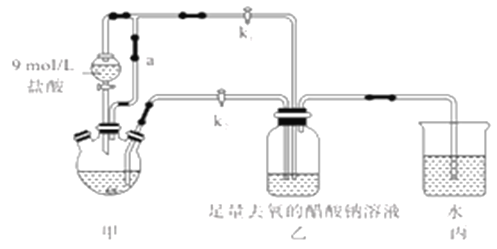
①检查装置气密性,往三颈烧瓶中依次加入过量锌粉,200mL0.200mol/LCrC13溶液。
②关闭k2打开k1,旋开分液漏斗的旋塞并控制好滴速。
③待三颈烧瓶內的溶液由深绿色(Cr3+)变为亮蓝色(Cr2+)时,把溶液转移到装置乙中。当出现大量红棕色晶体时,关闭分液漏斗的旋塞。
④将装置乙中混合物快速过滤、洗涤和干燥,称量得到11.28g[Cr(CH3COO)2]2·2H2O
(1)装置甲中连通管a的作用是________,如何检验甲装置的气密性是否良好?__________。
(2)生成红棕色晶体的离子反应方程式____________________________。
(3)步骤③中溶液自动转移至装置乙中的实验操作为________________。
(4)装置丙的作用是________________。
(5)为得到纯净干燥的产品,洗涤时按使用的先后顺序选用下列洗涤剂__________(填序号)。
①乙醚 ②蒸馏水(煮沸冷却) ③无水乙醇 ④盐酸
(6)本实验中[Cr(CH3COO)2]2·2H2O的产率是______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com