
| 族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 2 | ⑥ | ⑦ | ||||||
| 3 | ① | ③ | ⑤ | ⑧ | ⑩ | |||
| 4 | ② | ④ | ⑨ |
 .
.分析 由元素在周期表中位置,可知①为Na、②为K、③为Mg、④为Ca、⑤为Al、⑥为C、⑦为N、⑧为Cl、⑨为Br、⑩为Ar.
(1)同周期自左而右原子半径减小,同主族自上而下原子半径增大;
(2)非金属性越强,最高价含氧酸的酸性越强;氢氧化铝是两性氢氧化物;
(3)⑦元素的最高价氧化物对应水化物与其氢化物能生成盐M为NH4NO3;
(4)③与⑧形成化合物为MgCl2,属于离子化合物;
(5)海水提溴原理:先将浓缩海水中的Br-用氯气氧化,再将溴吹入吸收塔,使溴蒸汽和二氧化硫吸收剂发生作用转变成氢溴酸得到富集溴,用氯气将富集的溴负离子氧化得到产品溴.
解答 解:由元素在周期表中位置,可知①为Na、②为K、③为Mg、④为Ca、⑤为Al、⑥为C、⑦为N、⑧为Cl、⑨为Br、⑩为Ar.
(1)同周期自左而右原子半径减小,同主族自上而下原子半径增大,故③~⑦元素中,原子半径最大的是Ca,故答案为:Ca;
(2)上述元素中Cl元素非金属性最强,故最高价含氧酸中HClO4的酸性最强;Al(OH)3是两性氢氧化物,故答案为:HClO4;Al(OH)3;
(3)⑦元素的最高价氧化物对应水化物与其氢化物能生成盐M为NH4NO3,含有离子键、共价键,
故答案为:离子键、共价键;
(4)③与⑧形成化合物为MgCl2,属于离子化合物,用电子式表示其形成过程为 ,
,
故答案为: ;
;
(5)将溴吹入吸收塔,使溴蒸汽和二氧化硫吸收剂发生作用转变成氢溴酸得到富集溴,离子方程式为Br2+SO2+2H2O=4H++SO42-+2Br-,
故答案为:Br2+SO2+2H2O=4H++SO42-+2Br-.
点评 本题考查元素周期表与元素周期律应用,难度不大,注意掌握用电子式表示化学键或物质的形成过程.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
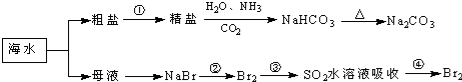
| A. | 工业上通过电解熔融状态MgCl2制取金属镁 | |
| B. | 在第②、④步骤中,溴元素均被氧化 | |
| C. | 用澄清的石灰水可鉴别NaHCO3和Na2CO3 | |
| D. | 制取NaHCO3的反应是利用其溶解度小于NaCl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(HF)<c(F-) | B. | c(Na+)<c(F-) | ||
| C. | c(F-)-c(HF)=c(H+)-c(OH-) | D. | c(HF)+c(F-)=0.1mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH<7的溶液中:Al3+、K+、SO32-、Cl- | |
| B. | 加入铝粉能放出氢气的溶液中:CO32-、AlO2-、I-、NO3- | |
| C. | 能使pH试纸变深蓝色的溶液中:S2-、SO32-、S2O32-、SO42- | |
| D. | 由水电离出的[OH-]=1×10-13mol/L的溶液中:Fe2+、NH4+、ClO-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 如表为元素周期表前四周期,其中的字母代表相应的元素.
如表为元素周期表前四周期,其中的字母代表相应的元素.| a | |||||||||||||||||
| b | c | d | |||||||||||||||
| e | f | g | k | ||||||||||||||
| h | I | j |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有Na2O | B. | 只有Na2O2 | C. | Na2O2和Na2O | D. | 无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在镀件上电镀铜时,可用金属铜作阳极 | |
| B. | 镀层破损后,白铁(镀锌)比马口铁(镀锡)更易被腐蚀 | |
| C. | 工业上电解饱和食盐水制烧碱,用阳离子交换膜阻止OH-移向阳极 | |
| D. | 钢铁在发生析氢腐蚀和吸氧腐蚀时,完全相同的反应是负极反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com