
实验室以空气(O2体积分数20%)为原料,在无碳、无水的环境下,用下图A装置制备臭氧(3O2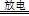 2O3)。
2O3)。
(1)空气通入A装置之前,应先后通过上述装置中的 、 (填装置序号)。
(2)臭氧与碘化钾溶液反应为:2KI+O3+H2O=2KOH+I2+O2。将a处气体通入装置B,溶液中的现象为 。
(3)为测定O2转化为O3的转化率,将装置B中的溶液全部转入另一容器中,加入CC14,经萃取、分液、蒸馏、冷却、称重,得I2固体0.254g。
①萃取操作所用玻璃仪器的名称 。
②若实验时通入空气1.12L(标准状况),O2的转化率为 。
③测定时需在A、B装置间连接装置D,原因是 。
(4)工业上分离O3和O2,可将混合气体液化后再分离,下列分离方法合理的是 (填序号)。
A.过滤 B.分馏 C.分液 D.萃取
(5)臭氧可用于含CN一碱性电镀废水的处理。第i步:CN一转化为OCN-;第ii步:OCN一继续转化为CO32一及两种单质气体。若第ii步转化时,O3与OCN-物质的质量之比为3∶2,该步反应的离子方程式为 。
(15分)(1)D、C(各1分,2分)
(2)溶液变黄色(其他合理答案给分,2分)
(3)①分液漏斗(1分)
②15%(3分)
③除去混合气体中的氮氧化物(其他合理答案给分,2分)
(4)B(2分)
(5)2OCN—+2OH—+3O3=2CO32一+N2+3O2+H2O(3分)
【解析】
试题分析:(1)根据无碳无水环境条件,则空气通入A装置前应先后通过NaOH溶液、浓H2SO4的洗气瓶;(2)a处气体通入B,臭氧能氧化KI,溶液中因生成的I2变黄;(3)①萃取使用分液漏斗、烧杯;②由m/M可知n(I2)=0.254g÷254g/mol=0.001mol,由2KI+O3+H2O=2KOH+I2+O2可知,n(O3)=0.001mol,由3O2 2O3可知,n(O2)=0.0015mol,由V/Vm可知n(空气)=0.05mol,由空气的组成可知,n(O2)=0.01mol,因此O2得转化率为0.0015÷0.01×100%=15%;③NaOH溶液能除去空气中氮气和氧气在放电时产生的氮氧化物,防止NO2与KI溶液反应;(4)臭氧和氧气先液化,二者沸点不同,可用分馏的方法分离,故B正确;(5)第一步反应中碳元素由+2价升为+4价,第二步反应中氮元素由—3价升为0价,部分氧元素由0价将为—2价,则两步反应分别为O3+CN—=OCN—+O2、2OCN—+2OH—+3O3=2CO32一+N2+3O2+H2O。
2O3可知,n(O2)=0.0015mol,由V/Vm可知n(空气)=0.05mol,由空气的组成可知,n(O2)=0.01mol,因此O2得转化率为0.0015÷0.01×100%=15%;③NaOH溶液能除去空气中氮气和氧气在放电时产生的氮氧化物,防止NO2与KI溶液反应;(4)臭氧和氧气先液化,二者沸点不同,可用分馏的方法分离,故B正确;(5)第一步反应中碳元素由+2价升为+4价,第二步反应中氮元素由—3价升为0价,部分氧元素由0价将为—2价,则两步反应分别为O3+CN—=OCN—+O2、2OCN—+2OH—+3O3=2CO32一+N2+3O2+H2O。
考点:考查物质的制备、KI的主要性质、萃取、氧气转化率的计算、氮氧化物的产生和处理、分馏、氧化还原反应、离子方程式的书写等相关知识。


 目标测试系列答案
目标测试系列答案科目:高中化学 来源: 题型:阅读理解
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
 Ⅰ高纯MnCO3是制备高性能磁性材料的主要原料.
Ⅰ高纯MnCO3是制备高性能磁性材料的主要原料.
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解

| ||
| ||

| 高温 |
| 高温 |
| 高温 |
查看答案和解析>>
科目:高中化学 来源: 题型:
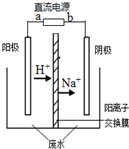 最近有研究人员发现了一种处理高浓度乙醛废水的新方法-隔膜电解法,乙醛分别在阴、阳极发生反应,转化为乙醇和乙酸.实验室以一定浓度的乙醛-Na2SO4溶液为电解质溶液,模拟乙醛废水的处理过程,其装置如图所示.下列说法正确的是( )
最近有研究人员发现了一种处理高浓度乙醛废水的新方法-隔膜电解法,乙醛分别在阴、阳极发生反应,转化为乙醇和乙酸.实验室以一定浓度的乙醛-Na2SO4溶液为电解质溶液,模拟乙醛废水的处理过程,其装置如图所示.下列说法正确的是( )查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com