
| A、42% | B、58% |
| C、36% | D、64% |
| ||
| ||
| ||
| 2×84g×1.55g |
| 62g |
| 5.8g |
| 10.0g |


科目:高中化学 来源: 题型:

| 砝码质量 | 50 | 20 | 20 | 10 | 5 |
| 取用砝码情况 | 先↓后↑ | ↓ | 先↓后↑ | ↓ | 先↓后↑ |


| 实验次数 | 初始温度t1/℃ | 混合液最高温度t2/℃ | |
| 盐酸 | NaOH溶液 | ||
| 1 | 19.9 | 20.0 | 23.2 |
| 2 | 20.0 | 20.1 | 23.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
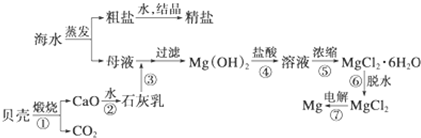
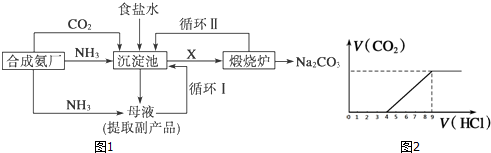
查看答案和解析>>
科目:高中化学 来源: 题型:
| t/s | 0 | 50 | 150 | 250 | 350 |
| n(PCl3)/mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
| A、反应在前50 s的平均速率v(PCl3)=0.0032mol?L-1?s-1 |
| B、保持其他条件不变,升高温度,平衡时c(PCl3)=0.11mol?L-1,则反应的△H<0 |
| C、相同温度下,起始时向容器中充入1.0mol PCl5、0.20mol PCl3和0.20mol Cl2,反应达到平衡前v(正)>v(逆) |
| D、相同温度下,起始时向容器中充入2.0mol PCl3和2.0mol Cl2,达到平衡时,PCl3的转化率小于80% |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.3 mol NO2、0.1 mol NO |
| B、0.3 mol NO、0.1 mol NO2 |
| C、0.6 mol NO |
| D、0.3 mol NO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、100 mL3 mol?L-1的硫酸与100 mL H2O混合,硫酸物质的量浓度改变为1.5 mol?L-1 |
| B、把100 g 20%的NaCl溶液与100 g H2O混合后,NaCl溶液的质量分数是10% |
| C、把200 mL3 mol?L-1的BaCl2溶液与100 mL 3 mol?L-1的KCl溶液混合后,溶液中的c(Cl-)仍然是3 mol?L-1 |
| D、把100 mL 20%的NaOH溶液与100 mL H2O混合后,NaOH溶液的质量分数是10% |
查看答案和解析>>
科目:高中化学 来源: 题型:
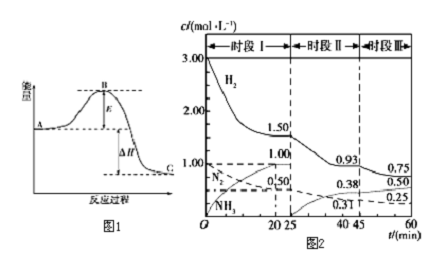
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com