
| A. | H2O、NH3•H2O、H3PO4 | B. | Cu(OH)2、CH3COOH、C2H5OH | ||
| C. | H2SO3、Ba(OH)2、BaSO4 | D. | H2SiO3、H2S、CO2 |
分析 电解质的强弱是根据电离程度划分的,在水溶液里或熔融状态下完全电离是电解质是强电解质,部分电离是电解质是弱电解质,强酸、强碱和大部分的盐属于强电解质.
解答 解:A.H2O部分电离,属于弱电解质、NH3•H2O是弱碱,属于弱电解质、H3PO4,是弱酸,属于弱电解质,故A正确;
B.C2H5OH不能电离,属于非电解质,故B错误;
C.氢氧化钡是强碱,硫酸钡是盐,属于强电解质,故C错误;
D.二氧化碳不能电离,属于非电解质,故D错误,
故选A.
点评 本题考查了强弱电解质的判断,明确电解质的强弱是根据电离程度划分的,注意不能根据电解质溶液的导电性强弱划分强弱电解质,为易错点,题目较简单.


科目:高中化学 来源: 题型:解答题
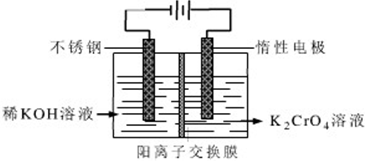
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 肯定有O2和NO | B. | 肯定没有Cl2、O2和NO2 | ||
| C. | 可能有Cl2和O2 | D. | 肯定只有NO |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验序号 | 甲 | 乙 | 丙 |
| 合金质量/mg | 255 | 385 | 459 |
| 生成气体体积/mL | 280 | 336 | 336 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该电池的正极板上覆盖有PbO2,负极板上覆盖有Pb | |
| B. | 该电池放电时的正极反应为PbO2(s)+4H+(aq)+SO2-4(aq)+2e-═PbSO4(s)+2H2O(l) | |
| C. | 该电池充电时,两个电极上都有PbSO4生成 | |
| D. | 用该电池电解饱和食盐水制氯气,若制得0.050molCl2,这时电池内消耗H2SO40.10mol |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 5.6LN2(标准状况)和11gCO2 | B. | 10gH2和10gO2 | ||
| C. | 9gH2O 和0.5molBr2 | D. | 22.4mlH2 (标准状况)和0.1molN2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com