
Ϊ̽����ˮ�к��еIJ������Ӽ�ijЩ���ӵ����ʣ�ij��ѧ��ȤС����������ʵ�飺
(1)�۲���ˮ��ɫ��������ˮ�ʻ���ɫ��˵����ˮ�к��е�������________��
(2)����ˮ�е���̼������Һ�����������ɣ�˵����ˮ�к��е�������________��
(3)��ʢ����ˮ���Թ��з������ɫ������ɫ��˵����ˮ�к��е�������________��
(4)д��������ˮ��Ӧ�Ļ�ѧ����ʽ��_____________________________________��
(5)д���������������Ӧ�Ļ�ѧ����ʽ��_________________________________��

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�����Ϊ2 L���ܱ������У��������»�ѧ��Ӧ��
CO2(g)��H2(g) CO(g)��H2O(g) ��H=Q����ѧƽ�ⳣ��K���¶�T�Ĺ�ϵ���±���
CO(g)��H2O(g) ��H=Q����ѧƽ�ⳣ��K���¶�T�Ĺ�ϵ���±���
| T/�� | 700 | 800 | 850 | 1 000 | 1 200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
�ش��������⣺
��1��Q____0���� ��>������<�����������¶ȣ���ѧƽ����________(�����Ӧ�����淴Ӧ��)�����ƶ���
��2����ij�¶��£�ƽ��Ũ�ȷ������й�ϵ��c(CO2)��c(H2)��c(CO)��c(H2O)����ʱ���¶�Ϊ__________���ڴ��¶��£����������к���1mol CO2��3mol H2��2mol CO��2mol H2O�����ʱ��Ӧ������״̬Ϊ____________(�������Ӧ��������С��������淴Ӧ��������С���ƽ��״̬��)�����¶�ƽ��ʱCO2��Ũ��Ϊ___________ mol��L��1���ڴ��¶��£����������к���1.5mol CO2��3.5mol H2��1.5mol CO��1.5mol H2O�ﵽƽ��ʱCO2��Ũ��Ϊ___________ mol��L��1��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
ij��ɫ��Һ�п��ܺ���Mg2����NH4����K����Al3����SO42����CO32����Cl�������ӡ��ֽ�������ʵ�飺��ȡ10mL����Һ���Թ��У��μ�Ba(NO3)2��Һ����ϡ�����ữ����˵õ�6.99g��ɫ����������ȡ10mL����Һ���Թ��У��μ�NaOH��Һ������ɫ���������������ӵ�һ������ʼ�������壨��Ҫʱ�ɼ��ȣ�����������ȫ�ܽ⣬������NaOH��Һ�ļ��룬�������������ʵ����仯��ͼ��ʾ������˵����������ʵ����
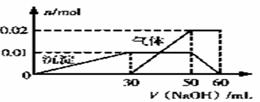
A. ������Ϣ��������Һ����ɫ��Ӧ����ɫ�����ӵ����ʵ���Ũ��Ϊ1 mol��L-1
B. ����ͼ�����ݼ���ʵ����ʹ�õ�NaOH��Һ��Ũ��Ϊ1 mol��L-1
C. ����Һ��NH4����Al3����SO42���������ӵ����ʵ���֮��Ϊ2:1:3
D. ��ȡһ��������Һ�μ�һ����Ba(OH)2��Һ��������Al3����SO42��ͬʱ��ȫ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����ͼʾ�����ݲ����Ǻϵ���(����)
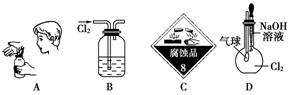
A������������ζ B������ˮ���ռ�����
C��ʢװҺ�ȵ����� D��֤������������NaOH��Һ��Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����6.02��1023��O��H2SO4�����ʵ�����(����)
A��1.00 mol B��0.50 mol
C��0.25 mol D��0.125 mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
(1)1 mol CO2���________mol C��________mol O��
(2)1.80 mol CO2�к���________��CO2���ӣ�________��Cԭ�ӣ�________��Oԭ�ӡ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��ǰ�ҹ����ٵ���ս�н�������������Դ����ʳ�ȷ�������⡣
(1)��ѧ�о��Ŀ���ܶ࣬��ٸ�Ч���ʵĺϳɣ�����ҩ����з������ڵͺ��������·ֽ�ˮ�Ƶ�����Ϊȼ�ϣ���Ѱ��������ɫ��Ⱦ����;��������������Ѫ�ܡ��ؽڵȣ������������������½��л����������߿������ܡ�ˮ�ܡ���ϫ�ܵȣ������Ƹ�Ч����ϴ�·ۡ�
�������ڽ����������__________(����ţ���ͬ)���������ڻ����������____________������������Դ�������____________������������ʳ�������____________��
(2)�г��ϳ��ֵġ���������ơ������ӵ�ʳ�Ρ������������ࡱ����Ʒ����Щ��Ʒ�еĸơ��⡢��Ӧ����Ϊ________��
A��ԭ�� B������ C������ D��Ԫ��
(3)ij����Ƭ�к�������ϸС�Ļ�ԭ���ۣ�ʳ��������Ƭ����������θҺ�б�������Σ��䷴Ӧ�Ļ�ѧ����ʽΪ___________________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��������ĵ���ƽ�ⳣ�����±���
| ���� | HCOOH | HCN | H2CO3 |
| ����ƽ�ⳣ��(25��) | K=1.77��10��4 | K=4.9��10��10 | K1=4.3��10��7 K2=5.6��10��11 |
����˵����ȷ����
A��0.1mol��L��1 NaHCO3��Һ��Ũ�ȵĴ�С��c(Na��)��c(HCO3��)��c(H��)��c(OH��)
B��������CO2ͨ�뵽NaCN��Һ�У�CN����H2O��CO2 = HCN��HCO3��
C����0.1mol��L��1 NaOH��Һ�к͵�Ũ�ȵ�HCN��HCOOHʱǰ������NaOH��Һ�����
D����ͬ�����0.1mol��L��1 HCOONa��Һ��0.1mol��L��1 NaCN��Һ������������С
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com