
| A. | 氯气、明矾净水原理相同 | |
| B. | 过氧化钠、活性炭均可用于呼吸面具 | |
| C. | 硅胶和铁粉均可用于食品的防氧化 | |
| D. | 甲烷的氯代物均可作防火材料 |
分析 A.氯气与水反应生成的HClO具有氧化性,明矾水解生成胶体净化水;
B.过氧化钠可作供氧剂,活性炭具有吸附性;
C.硅胶不具有还原性;
D.甲烷的氯代物中四氯化碳可作防火材料.
解答 解:A.氯气与水反应生成的HClO具有氧化性,明矾水解生成胶体净化水,则净水原理不同,故A不选;
B.过氧化钠可作供氧剂,活性炭具有吸附性,则均可用于呼吸面具,故B选;
C.硅胶不具有还原性,可作干燥剂,而铁粉可用于食品的防氧化,故C不选;
D.甲烷的氯代物中四氯化碳可作防火材料,其它不能,故D不选;
故选B.
点评 本题考查物质的性质及应用,为高频考点,把握物质的性质、性质与用途的关系为解答的关键,侧重分析与应用能力的考查,题目难度不大.


 英才点津系列答案
英才点津系列答案 红果子三级测试卷系列答案
红果子三级测试卷系列答案 课堂练加测系列答案
课堂练加测系列答案科目:高中化学 来源: 题型:解答题
 在一定条件下,N2和H2完全反应生成1molNH3放热46.0kJ热量.写出氨分解为氢气和氮气的热化学方程式2NH3(g)=N2(g)+3H2(g)△H=+92KJ/mol
在一定条件下,N2和H2完全反应生成1molNH3放热46.0kJ热量.写出氨分解为氢气和氮气的热化学方程式2NH3(g)=N2(g)+3H2(g)△H=+92KJ/mol查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ③④ | B. | ①② | C. | ②④ | D. | ①③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 红棕色的NO2气体加压后颜色先变深再变浅 | |
| B. | 打开汽水瓶,看到有大量的气泡逸出 | |
| C. | 二氧化硫转化为三氧化硫时增加空气的量以提高二氧化硫的转化率 | |
| D. | H2、I2、HI混合气体加压后颜色变深 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH3、H2、N2 | B. | H2、N2、O2 | C. | CO2、Cl2、HCl | D. | SO2、O2、H2S |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| N-N | N═N | N≡N | N-H | H-H |
| 193 KJ/mol | 418KJ/mol | 946KJ/mol | 391KJ/mol | 436KJ/mol |
 分别表示N2、H2、NH3和固体催化剂,则在固体催化剂表面合成氨的过程可用如图2表示:
分别表示N2、H2、NH3和固体催化剂,则在固体催化剂表面合成氨的过程可用如图2表示:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 上述四种元素的原子半径大小顺序为r(Z)>r(Y)>r(X)>r(W) | |
| B. | W和X、Y、Z均能形成18电子的分子 | |
| C. | Y2X和Y2X2中阴、阳离子个数之比均为1:2 | |
| D. | X、Y、Z三种元素形成的化合物,其水溶液一定呈碱性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
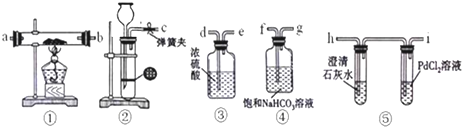
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 无色溶液中:Na+、Cl-、SCN-、Fe3+ | |
| B. | 碱性溶液中:Na+、AlO2-、Cl-、SO42- | |
| C. | 加入铝粉后产生氢气的溶液中:Ba2+、K+、NO3-、Al3+ | |
| D. | 无色溶液中:Na+、HCO3-、Cl-、OH- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com