
【题目】X、Y、Z、W为元素周期表前四周期的元素。其中X为形成的化合物中种类最多的元素,Y的内层电子数是最外层电子数的9倍,Z在元素周期表的各元素中电负性最大,W元素的第三电子层处于全充满状态且第四电子层只有2个电子。请回答下列问题.

(1)W元素在元素周期表中的位置为____________________________。
(2)比较XZ4和YZ2的熔沸点大小并说明理由________________________。
(3)W2+能与氨气分子形成配离子[W(NH3)4]2+。写出该配离子的结构简式(标明配位键)__。
(4)X能与氢、氮,氧三种元素构成化合物XO(NH2)2,其中X原子的杂化方式为__,1mol分子中σ键的数目为__,该物质易溶水的主要原因是_______________________。
(5)X的某种晶体为层状结构,可与熔融金属钾作用、钾原子填充在各层之间,形成间隙化合物,其常见结构的平面投影如图①所示,则其化学式时表示为_________。
(6)元素Y与元素Z形成的晶体结构如图②所示,晶胞中Y离子的配位数为_______。
【答案】第四周期ⅡB族 CF4比CaF2熔沸点低,原因是: CF4的晶体是分子晶体,熔融和沸腾时克服的是分子间作用力,CaF2是离子晶体,熔融和沸腾时克服的是离子键,分子间作用力比离子键弱的多 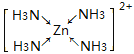 sp2 7NA CO(NH2)2分子与水分子之间能形成氢键 KC8 8
sp2 7NA CO(NH2)2分子与水分子之间能形成氢键 KC8 8
【解析】
X、Y、Z、M为元素周期表前四周期的元素,X原子核外的L层电子数是K层电子数的两倍,则X有2个电子层,最外层电子数为4,故X为C元素;Y的内层电子数是最外层电子数的9倍,Y只能处于第四周期,最外层电子数只能为2,内层电子总数为18,核外电子总数为20,故Y为Ca元素;Z在元素周期表的各元素中电负性最大,则Z为F元素,W元素的第三电子层处于全充满状态且第四电子层只有2个电子,则W的质子数为2+8+18+2=30,即W为Zn;可在此基础上对解各小题。
根据分析,X、Y、Z、W分别是C、Ca、F、Zn。
(1)W元素是Zn元素,核电荷数为30,在元素周期表中的位置为第四周期ⅡB族。答案为:第四周期ⅡB族
(2)XZ4和YZ2分别是CF4和CaF2,CF4的晶体是分子晶体,熔融和沸腾时克服的是分子间作用力,CaF2是离子晶体,熔融和沸腾时克服的是离子键。分子间作用力比离子键弱的多,所以,CF4比CaF2熔沸点低。答案为:CF4比CaF2熔沸点低,原因是: CF4的晶体是分子晶体,熔融和沸腾时克服的是分子间作用力,CaF2是离子晶体,熔融和沸腾时克服的是离子键,分子间作用力比离子键弱的多
(3)W2+和[W(NH3)4]2+分别是Zn2+和[Zn(NH3)4]2+,[Zn(NH3)4]2+中Zn2+有空轨道,每个N有一对孤对电子,所以Zn2+和4个NH3形成4个配位键,则配离子的结构简式为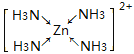 。答案为:
。答案为: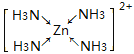
(4)X为C元素,则XO(NH2)2分子的结构简式为![]() ,C和3个原子相连,没有孤对电子,所以该分子中碳原子的杂化方式为sp2杂化,分子有1个双键,所含π键数目为1,σ键数目为1;单键数为6,均为σ键,所以σ键总数为1+6=7,所以1mol尿素中含有7molσ键,即7NA个σ键;因为
,C和3个原子相连,没有孤对电子,所以该分子中碳原子的杂化方式为sp2杂化,分子有1个双键,所含π键数目为1,σ键数目为1;单键数为6,均为σ键,所以σ键总数为1+6=7,所以1mol尿素中含有7molσ键,即7NA个σ键;因为![]() 含O和-NH2,与水分子间易形成氢键,所以该物质易溶水。答案为:sp2;7NA;CO(NH2)2分子与水分子之间能形成氢键
含O和-NH2,与水分子间易形成氢键,所以该物质易溶水。答案为:sp2;7NA;CO(NH2)2分子与水分子之间能形成氢键
(5)可以取如下图粗线所示的平行四边形为计算单位:
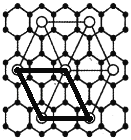
平行四边形顶点为钾,其完全占有的钾原子数是4×![]() =1,平行四边形内含有的碳原子数是8,故碳原子数和钾原子数之比是8∶1,则其化学式可表示为KC8。答案为:KC8
=1,平行四边形内含有的碳原子数是8,故碳原子数和钾原子数之比是8∶1,则其化学式可表示为KC8。答案为:KC8
(6)Y的离子是Ca2+,Z的离子是F-,所以Y和Z离子个数比为1:2,每个晶胞中位于顶点和面心的小球占有数是:8×![]() +6×
+6×![]() =4,晶体内的大球数为8,小球和大球的个数比为4:8=1:2,为保持电中性,小球应为Y离子(Ca2+),大球应为Z离子
=4,晶体内的大球数为8,小球和大球的个数比为4:8=1:2,为保持电中性,小球应为Y离子(Ca2+),大球应为Z离子


科目:高中化学 来源: 题型:
【题目】硫酸是重要的基础化工原料之一,是化学工业中最重要的产品,号称“工业之母”。在中学化学教材中有多处涉及其应用。
(1)利用浓硫酸配制稀硫酸
已知某浓硫酸的密度为1.84g/ml,质量分数为98%,则该浓硫酸的物质的量浓度为_______;
现用该浓硫酸配制480ml浓度为1.84mol/L的稀硫酸,在配制过程中除量取浓硫酸的仪器、烧杯、胶头滴管外,还需用到的玻璃仪器有______________________;
(2)硫酸与无机物的反应
实验室在用稀硫酸与锌反应制取氢气时,常向其中滴加少量硫酸铜溶液以加快反应速率,请写出发生的离子反应方程式______________________________;不活泼金属铜在与浓硫酸反应中,体现了浓硫酸的___________________性质;非金属碳在加热条件下也能与浓硫酸反应,若要你设计实验检验反应生成的气体产物,则检验出气体产物的正确顺序为______________________;
(3)硫酸在有机中的应用
利用硫酸的性质可以制取多种有机物,比如烈性炸药TNT、硝基化合物、酯类物质、不饱和烃等。请写出制取TNT的化学方程式________________________________________;请写出用乙醇制取乙烯的化学方程式________________________________________;稀硫酸还可以使蔗糖、淀粉等多种有机物发生水解,请写出蔗糖水解的产物名称_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】己知:![]() ;常温下,将盐酸滴加到N2H4的水溶液中,混合溶液中pOH[ pOH=-lgc(OH-)]随离子浓度变化的关系如图所示。下列叙述错误的是
;常温下,将盐酸滴加到N2H4的水溶液中,混合溶液中pOH[ pOH=-lgc(OH-)]随离子浓度变化的关系如图所示。下列叙述错误的是
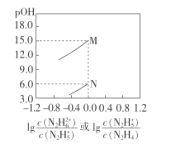
A.曲线M表示pOH与1g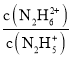 的变化关系
的变化关系
B.反应![]() 的
的![]()
C.pOH1>pOH2
D.N2H5Cl的水溶液呈酸性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高氯酸三碳酰肼合镍{[Ni(CHZ)3](ClO4)2}是一种新型的起爆药。
(1)写出基态Ni原子的外围电子排布图___。
(2)Ni能与CO形成配合物Ni(CO)4,配体CO中提供孤电子对的是C原子而不是O原子,其理由可能是___;1mol该配合物分子中σ键数目为___(设NA为阿伏伽德罗常数的值,下同)。
(3)①ClO4-的VSEPR模型是___。
②写出与ClO4-互为等电子体的一种分子:___(填化学式)。
(4)高氯酸三碳酰肼合镍化学式中的CHZ为碳酰肼,其结构为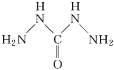 ,它是一种新型的环保锅炉水除氧剂。碳酰肼中氮原子和碳原子的杂化轨道类型分别为___、___。
,它是一种新型的环保锅炉水除氧剂。碳酰肼中氮原子和碳原子的杂化轨道类型分别为___、___。
(5)高氯酸三碳酰肼合镍可由NiO、高氯酸及碳酰肼化合而成。
①高氯酸的酸性强于次氯酸的原因是___。
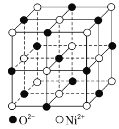
②如图为NiO晶胞,则晶体中Ni2+的配位数为___;若晶胞中Ni2+距离最近的O2-之间的距离为apm,则NiO晶体的密度=___g·cm-3(用含a、NA的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钽是一种过渡金属,钽酸锂(LiTaO3)可用于制作滤波器。一种制备钽酸锂的流程如下:回答下列问题:

(1)LiTaO3中钽的化合价为___。
(2)同体A呈红色,其主要成分是___(写化学式),常见用途有___(填一种即可)。
(3)操作2的名称是___,用来检验溶液B中阴离子的常用试剂是___。
(4)HTaO3是___(填字母)。
a.难溶的强酸 b.可溶的弱酸 c.可溶的强酸 d.难溶的弱酸
(5)烧渣与NaOH溶液转化成溶液A的过程中,发生反应的离子方程式为___。
(6)上述废料中含Ta2O5的质量分数为44.2%,杂质不含Ta元素。现有100kg该废料,按上述流程最多可制备___kgLiTaO3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】还原法处理氮的氧化物是环境科学研究的热点课题。
I.氧气还原法。H2还原NO发生的反应为:2NO(g)+2H2(g)![]() N2(g)+2H2O(g)。
N2(g)+2H2O(g)。
(1)已知儿种化学键的键能数据如下:

2NO(g)+2H2(g)![]() N2(g)+2H2O(g) ΔH=___kJ·mol-1。
N2(g)+2H2O(g) ΔH=___kJ·mol-1。
(2)2NO(g)+2H2(g)![]() N2(g)+2H2O(g)的反应速率表达式为v=kc2(NO)·c(H2)(k是速率常数,只与温度有关)。科学研究发现上述反应分两步进行:
N2(g)+2H2O(g)的反应速率表达式为v=kc2(NO)·c(H2)(k是速率常数,只与温度有关)。科学研究发现上述反应分两步进行:
反应1:2NO(g)+H2(g)![]() N2(g)+H2O2(g);
N2(g)+H2O2(g);
反应2:H2O2(g)+H2(g)![]() 2H2O(g)。
2H2O(g)。
总反应速率由反应较慢的一步决定,由此推知上述两步反应中,活化能较大的是反应___(填“l”或“2”)。c(NO)对总反应速率的影响程度___c(H2)(填“大于”“小于”或“等于”)。
Ⅱ.NH3还原法。在恒容密闭容器中充入NH3和NO2,在一定温度下发生反应:8NH3(g)+6NO2(g)![]() 7N2(g)+12H2O(g)。
7N2(g)+12H2O(g)。
(3)下列表明该反应达到平衡状态的是___(填字母)。
A.混合气体密度保持不变 B.NO2和N2的消耗速率之比为6:7
C.混合气体中c(N2)=c(NO2) D.混合气体压强保持不变
III.CO还原法。利用高效催化剂处理汽车尾气中的NO和CO,发生反应:2CO(g)+2NO(g)![]() N2(g)+2CO2(g) ΔH。在2L恒容密闭容器中充人2molCO和2molNO,测得NO的转化率与温度、时间的火系如图所示。
N2(g)+2CO2(g) ΔH。在2L恒容密闭容器中充人2molCO和2molNO,测得NO的转化率与温度、时间的火系如图所示。
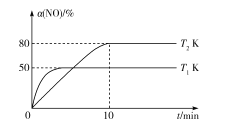
(4)下列说法正确的是___(填字母)。
A.图像中,T1>T2
B.上述反应在高温下能自发进行
C.10min时,T2K下正、逆反应速率相等
D.增大NO的浓度,反应物的转化率增大
(5)T2K温度下,0-10min内用CO表示的平均反应速率v(CO)=___mol/L-1·min-1;T1K温度下,上述反应的平衡常数K=___L·mol-1。
(6)T1K温度下,向平衡后的容器内再加入2molN2和2molNO,则平衡___(填“向右移动”“向左移动”或“不移动”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将4 mol A气体和1mol B气体在2 L的容器内混合,在一定条件下发生反应: 2A(g) +B(g)![]() 3C(g),若2 min后测得C的浓度为0.6 mol·L-1,则下列说法正确的是
3C(g),若2 min后测得C的浓度为0.6 mol·L-1,则下列说法正确的是
A. 用物质A表示反应的平均速率为v(A)= 0.4 mol·(L·min)-1
B. 2 min时A、B、C三种气体的总量为5mol
C. 2 min时B的转化率为20%
D. 若2 min后该反应达平衡,则各种气体的量不再变化,反应停止
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镍镉(Ni—Cd)可充电电池在现代生活中有广泛应用。已知某镍镉电池的电解质溶液为KOH溶液,其充、放电按下式进行:Cd + 2NiOOH + 2H2O![]() Cd(OH)2 + 2Ni(OH)2。有关该电池的说法正确的是
Cd(OH)2 + 2Ni(OH)2。有关该电池的说法正确的是
A.充电时阳极反应:Ni(OH)2 -e— + OH- = NiOOH + H2O
B.充电过程是化学能转化为电能的过程
C.放电时负极附近溶液的碱性不变
D.放电时电解质溶液中的OH-向正极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】5﹣二甲氧基苯酚是重要的有机合成中间体,可用于天然物质白柠檬素的合成,一种以间苯三酚为原料的合成反应如下:

甲醇、乙醚和3,5﹣二甲氧基苯酚的部分物理性质见下表:
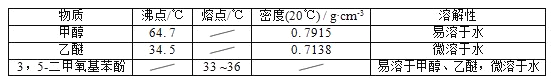
(1)反应结束后,先分离出甲醇,再加入乙醚进行萃取,①分离出甲醇的操作是的______;②萃取用到的分液漏斗使用前需__________________并洗净,分液时有机层在分液漏斗的________填(“上”或“下”)层;
(2)分离得到的有机层依次用饱和NaHCO3溶液、饱和食盐水、少量蒸馏水进行洗涤.用饱和NaHCO3溶液洗涤的目的是__,用饱和食盐水洗涤的目的是______;
(3)洗涤完成后,通过以下操作分离、提纯产物,正确的操作顺序是__(填字母);
a.蒸馏除去乙醚 b.重结晶 c.过滤除去干燥剂 d.加入无水CaCl2干燥
(4)固液分离常采用减压过滤.为了防止倒吸,减压过滤完成后应先________________,再______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com