


科目:高中化学 来源:不详 题型:单选题
| A.用萃取的方法可将汽油和煤油进行分离 |
| B.加过量稀盐酸后过滤,可除去混在铜粉中的少量镁粉和铝粉 |
| C.用溶解、过滤的方法可分离硝酸钾和氯化钠固体混合物 |
| D.将混有氢气的氧气通过灼热的氧化铜,以除去其中的氢气 |
查看答案和解析>>
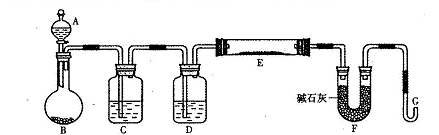
科目:高中化学 来源:不详 题型:实验题
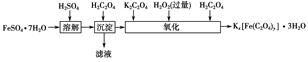
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
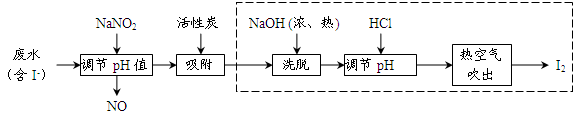
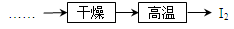
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| 编号 | A | B | C | D |
| 实验 方案 |  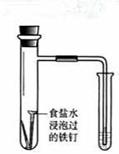 食盐水 | 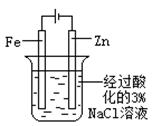 片刻后在Fe电极附近滴入K3[Fe(CN)6]溶液 | 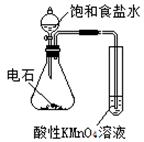 | 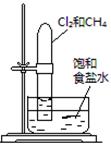 置于光亮处 |
| 实验 目的 | 验证铁钉发生 析氢腐蚀 | 验证Fe电极被保护 | 验证乙炔的还原性 | 验证甲烷与氯气发生 化学反应 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.用米汤检验食用加碘盐中含有碘 |
| B.用醋、石灰水验证蛋壳中含有碳酸盐 |
| C.用碘酒检验汽油中是否含有不饱和烃 |
| D.用鸡蛋白、食盐、水完成蛋白质的溶解、盐析实验 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
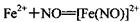 (棕色)。已知,同浓度的硝酸氧化性比Fe3+略强。
(棕色)。已知,同浓度的硝酸氧化性比Fe3+略强。查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com