

 ),其分子中相邻的C和N原子相比,N原子吸引电子能力更强(填“强”或“弱”),从原子结构角度解释原因:C和N原子在同一周期(或电子层数相同),N原子核电荷数更大,原子半径更小,原子核对外层电子的吸引力更强.
),其分子中相邻的C和N原子相比,N原子吸引电子能力更强(填“强”或“弱”),从原子结构角度解释原因:C和N原子在同一周期(或电子层数相同),N原子核电荷数更大,原子半径更小,原子核对外层电子的吸引力更强.分析 (1)氨气在催化剂条件下与氧气反应生成一氧化氮和水;
(2)由图表可知,氮由+2价变成0价,应加还原剂;
(3)N的电负极强,所以N原子吸引电子能力更强,C和N原子在同一周期(或电子层数相同),N原子核电荷数更大,原子半径更小,原子核对外层电子的吸引力更强;
(4)N2(g)+O2(g)═2NO(g)△H=a kJ•mol-1 …①;N2(g)+3H2(g)═2NH3(g)△H=b kJ•mol-1…②;2H2(g)+O2(g)═2H2O(l)△H=c kJ•mol-1…③;3③-3①-2②得到4NH3(g)+6NO(g)═5N2(g)+6H2O(l),运用盖斯定律解题.
解答 解:(1)氨气在催化剂条件下与氧气反应生成一氧化氮和水,为重要的工业反应,反应的化学方程式4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O,
故答案为:4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O;
(2)氮由+2价变成0价,应加还原剂,CO和氨气,故选:bd;
(3)N的电负极强,所以N原子吸引电子能力更强,由于C和N原子在同一周期(或电子层数相同),N原子核电荷数更大,原子半径更小,原子核对外层电子的吸引力更强,故答案为:强;C和N原子在同一周期(或电子层数相同),N原子核电荷数更大,原子半径更小,原子核对外层电子的吸引力更强;
(4)已知:N2(g)+O2(g)═2NO(g)△H=a kJ•mol-1 …①;N2(g)+3H2(g)═2NH3(g)△H=b kJ•mol-1…②;2H2(g)+O2(g)═2H2O(l)△H=c kJ•mol-1…③;而①的反应为:4NH3(g)+6NO(g)═5N2(g)+6H2O(l),所以△H=3③-3①-2②,则△H=(3c-3a-2b) kJ•mol-1,所以热化学方程式为:4NH3(g)+6NO(g)═5N2(g)+6H2O(l)△H=(3c-3a-2b) kJ•mol-1,故答案为:4NH3(g)+6NO(g)═5N2(g)+6H2O(l)△H=(3c-3a-2b) kJ•mol-1.
点评 本题考查较为综合,涉及氨气的制备、性质以及氮氧化物的性质,侧重于基础知识的考查,题目较为简单,注意相关基础知识的学习与积累.


科目:高中化学 来源: 题型:选择题
| A. | 13.6g | B. | 10.2g | C. | 6.8g | D. | 1.7g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe(OH)3胶体无色、透明,能产生丁达尔效应 | |
| B. | 硫酸溶液的导电性一定比醋酸溶液的导电性强 | |
| C. | 用萃取分液的方法除去酒精中的水 | |
| D. | SO3溶于水后得到的溶液可以导电,但SO3是非电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
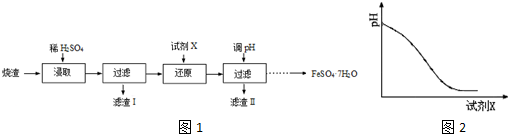
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 操 作 | 现 象 |
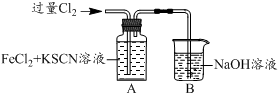 | I.A中溶液变红 II.稍后,溶液由红色变为黄色 |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 用下图表示的一些物质或概念间的从属关系中不正确的是( )
用下图表示的一些物质或概念间的从属关系中不正确的是( )| X | Y | Z | |
| A | 甲烷 | 烃 | 有机化合物 |
| B | 胶体 | 分散系 | 混合物 |
| C | 置换反应 | 氧化还原反应 | 离子反应 |
| D | 碱性氧化物 | 金属氧化物 | 氧化物 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 (或
(或
 ).
).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 打开冰镇啤酒瓶把啤酒倒入玻璃杯,杯中立即泛起大量泡沫 | |
| B. | 镀层破损后,马口铁(镀锡的铁)比白铁(镀锌的铁)更易腐蚀 | |
| C. | 加热后的纯碱水洗油污比冷碱水效果好 | |
| D. | FeCl3滴入沸水中,煮沸片刻得到红褐色胶体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com