
| A.陶瓷的主要成分是碳酸钙 |
| B.用铁容器存放浓盐酸 |
| C.工业上利用氨气制硝酸属于人工固氮 |
| D.硅是制造半导体的常用材料 |
 中考解读考点精练系列答案
中考解读考点精练系列答案科目:高中化学 来源:不详 题型:单选题
| A.制饭勺、饭盒、高压锅等的不锈钢是合金 |
| B.做衣服的棉和麻均与淀粉互为同分异构体 |
| C.煎炸食物的花生油和牛油都是可皂化的饱和酯类 |
| D.磨豆浆的大豆富含蛋白质,豆浆煮沸后蛋白质变成了氨基酸 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
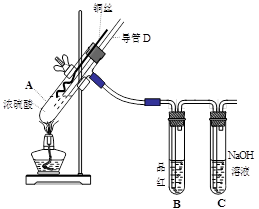
|
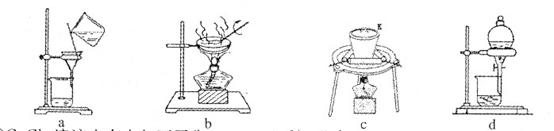
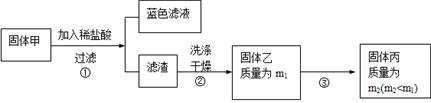 (3) 固体乙在空气中煅烧时,使用的实验仪器除了玻璃棒、三脚架、酒精灯外,还必须有: 。
(3) 固体乙在空气中煅烧时,使用的实验仪器除了玻璃棒、三脚架、酒精灯外,还必须有: 。查看答案和解析>>
科目:高中化学 来源:不详 题型:推断题
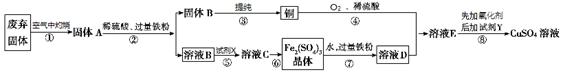
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.将铜丝插入浓硫酸中加热,反应后把水加入反应器中,观察硫酸铜溶液的颜色 |
| B.常温下将铜丝伸入盛满氯气的集气瓶中,观察CuCl2的生成 |
| C.将CuCl2溶液在蒸发皿中加热蒸干,得到无水CuCl2固体 |
| D.将表面有铜绿[Cu2(OH)2CO3]的铜器放入盐酸中浸泡,除去铜绿 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
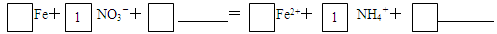
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.利用铁加入硫酸铜溶液中的反应可以比较Cu、Fe2+的还原性 |
| B.足量的铜跟一定量的浓硝酸反应只产生一种气体 |
| C.氮的固定只有在高温、高压、催化剂的条件下才能实现 |
| D.以铁为阴极、铜片为阳极、硫酸铜为电镀液可以实现铁制品镀铜 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
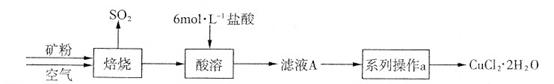
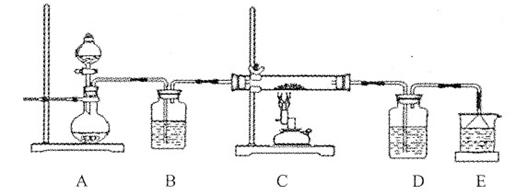
 CuCl42-(黄色)+4H2O。
CuCl42-(黄色)+4H2O。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com