

分析 (1)若A为气体,其水溶液能使湿润的红色石蕊试纸变蓝,则A为NH3,B为NO,C为NO2,D为HNO3;
(2)A、D的水溶液均能使湿润的蓝色石蕊试纸变红,为酸性物质,B、C都为酸性氧化物,如符合转化关系,则A应为H2S,B为SO2,C为SO3,D为H2SO4;
(3)若D为常见的强碱,则A为Na,B为Na2O,C为Na2O2,D为NaOH.
解答 解:A、B、C、D均为中学化学中的常见物质,且均含有同-种元素,依据转化关系分析得到,
(1)若A为气体,其水溶液能使湿润的红色石蕊试纸变蓝,说明A为减小气体则A为NH3,B为NO,C为NO2,D为HNO3,工业上合成A的化学方程式为:N2+3H2$\frac{\underline{\;\;催化剂\;\;}}{高温高压}$2NH3,
故答案为:N2+3H2$\frac{\underline{\;\;催化剂\;\;}}{高温高压}$2NH3;
(2)A、D的水溶液均能使湿润的蓝色石蕊试纸变红,AD为酸性物质,B、C都为酸性氧化物,转化关系可知D为酸,如符合转化关系,则A应为H2S,B为SO2,C为SO3,D为H2SO4,B为二氧化硫和水反应生成亚硫酸,反应的化学方程式为:SO2+H2O=H2SO3 ,
故答案为:H2SO4,SO2+H2O=H2SO3;
(3)若D为常见的强碱,则A为Na,B为Na2O,C为Na2O2,D为NaOH,C为Na2O2和水反应生成氢氧化钠和氧气,反应的离子方程式为:2Na2O2+2H2O=4Na++4OH-+O2↑,
故答案为:Na2O,2Na2O2+2H2O=4Na++4OH-+O2↑.
点评 本题考查无机物推断,为高频考点,侧重于学生的分析能力的考查,难度中等,需要学生熟练掌握元素化合物知识,注意掌握中学常见连续氧化反应.


 桃李文化快乐暑假武汉出版社系列答案
桃李文化快乐暑假武汉出版社系列答案 优秀生快乐假期每一天全新寒假作业本系列答案
优秀生快乐假期每一天全新寒假作业本系列答案 暑假接力赛新疆青少年出版社系列答案
暑假接力赛新疆青少年出版社系列答案科目:高中化学 来源: 题型:选择题
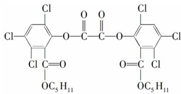
| A. | 它属于芳香族化合物 | |
| B. | 它的分子式为C26H24O8Cl6 | |
| C. | 它难溶于水 | |
| D. | 1 mol这种物质最多可以跟6mol NaOH反应 |
查看答案和解析>>
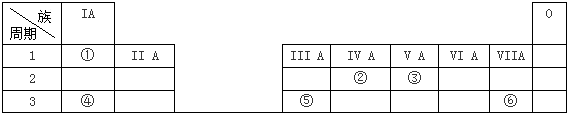
科目:高中化学 来源: 题型:选择题
| A. | 在整个18列元素中,第1列的元素种类最多 | |
| B. | 只有第2列元素原子最外层有2个电子 | |
| C. | 第1列元素均为金属元素 | |
| D. | 第9列元素中没有非金属元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 甲 | 乙 | |
| 丙 | 丁 | 戊 |
| A. | 原子半径:丙<丁<戊 | B. | 金属性:甲<丙 | ||
| C. | 氢氧化物的碱性:丙>丁>戊 | D. | 最外层电子数:甲>乙 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
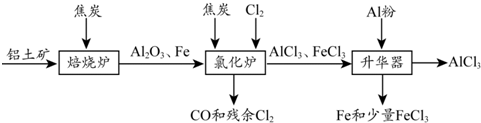
 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 二 | ① | ② | ||||||
| 三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |
| 四 | ⑩ | ⑪ | ⑫ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com