
在某温度下,H2和I2各0.10mol的气态混合物充入10L的密闭容器中,发生反应:H2(g)+I2(g) 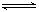 2HI(g),充分反应后达到平衡,测得c(H2)=0.008
mol•L-1,则该反应的平衡常数为( )
2HI(g),充分反应后达到平衡,测得c(H2)=0.008
mol•L-1,则该反应的平衡常数为( )
A. 40 B. 62.5 C. 0.25 D. 4
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:阅读理解
 化学在能源开发与利用中起着十分关键的作用.氢气是一种新型的绿色能源,又是一种重要的化工原料.
化学在能源开发与利用中起着十分关键的作用.氢气是一种新型的绿色能源,又是一种重要的化工原料.
| ||
时间(h) 物质的量(mol) |
0 | 1 | 2 | 3 | 4 |
| N2 | 1.50 | n1 | 1.20 | n3 | 1.00 |
| H2 | 4.50 | 4.20 | 3.60 | n4 | 3.00 |
| NH3 | 0 | 0.20 | N2 | 1.00 | 1.00 |
| 4 |
| 27 |
| 4 |
| 27 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| V2 |
| a2 |
| V2 |
| a2 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| n |
| 3 |
| n |
| 3 |
| V/s | 0 | 50 | 100 |
| c(N2O3)/mol?L-1 | 5.00 | 3.52 | 2.48 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| C(H2)?C(CO) |
| C(H2O) |
| 高温 |
| 高温 |
| 高温 |
查看答案和解析>>
科目:高中化学 来源:2012-2013学年浙江省瑞安十校高三上学期期末联考理综化学试卷(解析版) 题型:填空题
化学在能源开发与利用中起着十分关键的作用。氢气是一种新型的绿色能源,又是一种重要的化工原料。
I.氢氧燃料电池能量转化率高,具有广阔的发展前景。现用氢氧燃料电池进行如图实验(图中所用电极均为惰性电极):

(1)对于氢氧燃料电池中,下列表达不正确的是________
A.a电极是负极,OH-移向正极
B.b电极的电极反应为:O2+2H2O+4e-=4OH-
C.电池总反应式为:2H2+O2 2H2O
2H2O
D.电解质溶液的pH保持不变
E.氢氧燃料电池是一种不需要将还原剂和氧化剂全部储藏在电池内的新型发电装置
(2)上图装置中盛有100mL、0.1mol·L—1AgNO3溶液,当氢氧燃料电池中消耗氢气112mL(标准状况下)时,则此时上图装置中溶液的pH=________(溶液体积变化忽略不计)
II.氢气是合成氨的重要原料。工业上合成氨的反应是:
N2(g)+3H2(g) 2NH3(g)
ΔH=-92.20 kJ·mol-1。
2NH3(g)
ΔH=-92.20 kJ·mol-1。
(1)下列事实中,不能说明上述可逆反应已达到平衡的是________
①单位时间内生成2n mol NH3的同时生成3n mol H2
②单位时间内生成n mol N—H的同时生成n mol N≡N
③用N2、H2、NH3的物质的量浓度变化表示的反应速率之比为1︰3︰2
④N2、H2、NH3的体积分数不再改变
⑤混合气体的平均摩尔质量不再改变
⑥混合气体的总物质的量不再改变
(2)已知合成氨反应在某温度下2L的密闭容器中进行,测得如下数据:
|
时间(h) 物质的量(mol) |
0 |
1 |
2 |
3 |
4 |
|
N2 |
1.50 |
n1 |
1.20 |
n3 |
1.00 |
|
H2 |
4.50 |
4.20 |
3.60 |
n4 |
3.00 |
|
NH3 |
0 |
0.20 |
n2 |
1.00 |
1.00 |
根据表中数据计算:
反应进行到2小时时放出的热量为________
0~1小时内N2的平均反应速率________mol·L-1·h-1;
③此条件下该反应的化学平衡常数K=________(保留两位小数)
④反应达到平衡后,若往平衡体系中再加入N2、H2和NH3各1.00mol,化学平衡将向________ 方向移动(填“正反应”或“逆反应”、“不移动”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com