
 请根据所学知识回答下列问题:
请根据所学知识回答下列问题:分析 (1)常温时红磷比白磷稳定,说明白磷能量高,反应放出的热量较多;
(2)浓硫酸溶于水放热;
(3)依据热化学方程式和盖斯定律计算得到;
(4)原电池正极发生得电子的还原反应,结合原电池的总反应来分析正极反应;电镀时,镀层作阳极、镀件作阴极,所以阳极上铜失电子发生氧化反应、阴极上铜离子得电子发生还原反应;电镀后,两个电极质量差等于阳极溶解质量与阴极析出质量之和,根据金属和电子之间的关系式计算.
解答 解:(1)常温时红磷比白磷稳定,说明白磷能量高,反应放出的热量较多,因△H<0,则放出的能量越多反应热越小,
故答案为:<;
(2)浓硫酸溶于水放热,放出的热量多余57.3kJ,故答案为:>;
(3)①C3H8(g)→CH4(g)+HC≡CH(g)+H2(g)△H1=156.6kJ•mol-1
②CH3CH=CH2(g)→CH4(g)+HC≡CH(g)△H2=32.4kJ•mol-1
依据盖斯定律①-②得到C3H8(g)→CH3CH=CH2(g)+H2(g)△H=+124.2KJ/mol
则相同条件下,反应C3H8(g)→CH3CH=CH2(g)+H2(g)△H=+124.2KJ/mol;
故答案为:+124.2;
(4)原电池正极发生得电子的还原反应,在反应2Na+xS=Na2Sx中,硫单质得电子,故正极反应为:xS+2e-=Sx2-;
电镀时,镀层作阳极、镀件作阴极,所以阳极上铜失电子发生氧化反应,电极反应式为Cu-2e-=Cu2+,阴极上铜离子得电子发生还原反应,阴极反应式为Cu2++2e-=Cu;电镀后,两个电极质量差等于阳极溶解质量与阴极析出质量之和,若电镀前铁、铜两电极的质量相同,电镀完成后将它们取出洗净、烘干、称量,二者质量差为25.6g,所以阳极溶解铜的质量为12.8g,
设通过的电子为x,
Cu-2e-=Cu2+
64g 2mol
12.8g x
64g:2mol=12.8g:x,
x=0.4mol,
故流经电镀池的电极的电子的物质的量为0.4mol,而流经电镀池的电子的量与流经原电池中正负极的电子的量相同,设原电池负极上有Xg钠被消耗,
有:Na-e-=Na+
23g 1mol
Xg 0.4mol
可得 X=$\frac{23g×0.4mol}{1mol}$,
解得X=9.2g
故答案为:xS+2e-=Sx2-;9.2.
点评 本题考查较为综合,涉及化学反应与能量变化、原电池原理和电解原理的应用,题目难度中等,明确盖斯定律的运用、电极上发生的反应、以及电子守恒是解本题关键,侧重于考查学生的分析能力和计算能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 移液时,不慎将液体流到瓶外 | B. | 容量瓶中原有少量的蒸馏水 | ||
| C. | 容量瓶盛过KOH溶液,使用前未洗涤 | D. | 定容时俯视刻度线和液面 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
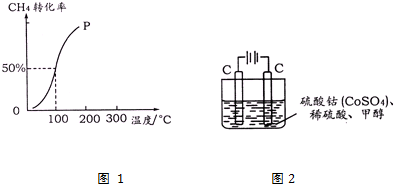
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 反应时间/min | n(CO)/mol | n(H2O)/mol |
| 0 | 1.20 | 0.60 |
| t1 | 0.80 | |
| t2 | 0.20 |
| A. | 反应在t1 min内的平均速率为v(H2)=$\frac{0.40}{{t}_{1}}$mol•L-1•min-1 | |
| B. | 保持其他条件不变,起始时向容器中充入0.60mol CO和1.20mol H2O,到达平衡时n(CO2)=0.40mol | |
| C. | 保持其他条件不变,向平衡体系中再通入0.20mol H2O(g),△H增大 | |
| D. | 温度升高至800℃,上述反应平衡常数为0.64,则正反应为吸热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
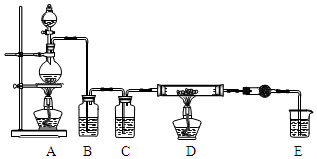 无水AlCl3是一种重要的化工原料.某课外探究小组尝试制取无水AlCl3,查阅资料获得下列信息:无水AlCl3在178℃升华,极易潮解,遇水蒸气产生白色烟雾.
无水AlCl3是一种重要的化工原料.某课外探究小组尝试制取无水AlCl3,查阅资料获得下列信息:无水AlCl3在178℃升华,极易潮解,遇水蒸气产生白色烟雾.| 第一次实验 | 第二次实验 | 第三次实验 | |
| D中固体用量 | 2.0g | 2.0g | 2.0g |
| 氢气的体积 | 334.5mL | 336.0mL | 337.5mL |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
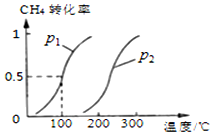 甲烷广泛存在于天然气、沼气、煤矿坑气之中,是优质的气体燃料,更是制造许多化工产品的重要原料.
甲烷广泛存在于天然气、沼气、煤矿坑气之中,是优质的气体燃料,更是制造许多化工产品的重要原料.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3COOH | B. | H2CO3 | C. | HCN | D. | HClO |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com