
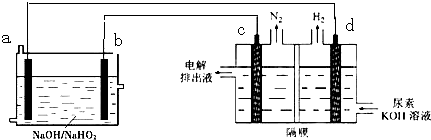
| A、燃料电池总反应为:3HO2-+2Al=OH-+2AlO2-+H2O |
| B、电极b是正极,且反应后该电极区pH增大 |
| C、每消耗27g Al,理论上产生11.2L(标准状况下)氮气 |
| D、反应时,电子的流向为:a→b→c→d. |


 全能测控期末小状元系列答案
全能测控期末小状元系列答案科目:高中化学 来源: 题型:

查看答案和解析>>
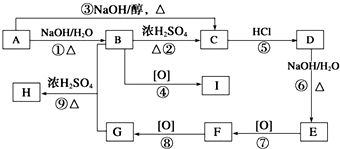
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
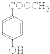 )出发,可发生图示的一系列反应,图中化合物D能使FeCl3溶液显紫色,G能进行银镜反应.E和H常温下为气体.试回答:
)出发,可发生图示的一系列反应,图中化合物D能使FeCl3溶液显紫色,G能进行银镜反应.E和H常温下为气体.试回答: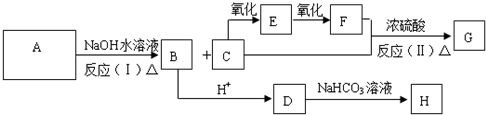
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2.24LH2含有的原子数为0.2NA |
| B、常温常压下,18gNH4+的电子数为10 NA |
| C、标准状况下,1NAH2O分子占有的体积约为22.4L |
| D、0.5 mol/L的AlCl3溶液中,Cl-的数目为1.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、室温下,1LpH=13的NaOH溶液中,由水电离的OH-离子数目为0.1NA |
| B、0.1molMg在空气中完全燃烧生成MgO和Mg3N2,转移的电子数为0.2NA |
| C、标准状况下,22.4 L Cl2溶于足量NaOH溶液中,转移的电子数目为0.2NA |
| D、1 L 0.1 mol?L-1的Fe2(SO4)3溶液中,Fe3+的数目为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、生石膏(2CaSO4?H2O):用于制造各种模型 |
| B、纯碱(NaHCO3):用于制玻璃、肥皂、纺织 |
| C、硫酸钡(BaSO4):作白色颜料、“钡餐” |
| D、胆矾(CuSO4):用于制造农药 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com