
| A. | 标准状况下,22.4 L己烷中共价键数目为19NA | |
| B. | 常温下,0.1 mol乙烷与乙烯混合气体中所含碳原子数为0.2NA | |
| C. | 在标准状况下,2.24 L四氯甲烷中所含分子数为0.1NA | |
| D. | 1 mol苯分子中含有碳碳双键数为3 NA |
 科学实验活动册系列答案
科学实验活动册系列答案科目:高中化学 来源: 题型:选择题
| A. | 溶解平衡的本质是结晶速率等于溶解速率 | |
| B. | 在不饱和溶液中,溶质的溶解速率小于结晶速率 | |
| C. | 在饱和溶液中,晶体的质量不改变,形状可能改变 | |
| D. | 当物质达到溶解平衡时,不改变外界条件,溶液的浓度也不改变 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
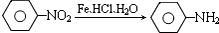 (苯胺、弱碱性、易被氧化)
(苯胺、弱碱性、易被氧化)
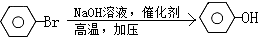


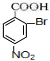 D:
D: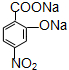 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
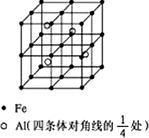 第四周期过渡元素Fe、Ti可与C、H、N、O形成多种化合物.
第四周期过渡元素Fe、Ti可与C、H、N、O形成多种化合物.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
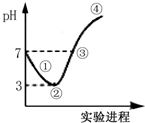 常温下,将Cl2缓缓通入水中至饱和,然后向所得饱和溶液中滴加0.1mol•L-1 NaOH溶液,整个过程中pH的变化如图所示.下列有关叙述正确的是( )
常温下,将Cl2缓缓通入水中至饱和,然后向所得饱和溶液中滴加0.1mol•L-1 NaOH溶液,整个过程中pH的变化如图所示.下列有关叙述正确的是( )| A. | 从反应开始至②点,发生反应的离子方程式为:Cl2+H2O═ClO-+2H++Cl- | |
| B. | ③处表示氯气和NaOH溶液恰好完全反应 | |
| C. | ②点所表示的溶液中所存在的具有氧化性的含氯元素的微粒主要有:Cl2、HClO、ClO- | |
| D. | 从反应开始至②点可用pH试纸测定溶液的pH |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 新制氯水中没有氯气分子 | |
| B. | 新制氯水在光照的条件下,可以产生气体,该气体是氯气 | |
| C. | 新制氯水中滴加硝酸银溶液,没有任何现象 | |
| D. | 新制氯水可以使干燥的布条褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ | ⑩ |
 .
.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com