
【题目】燃料电池具有能量转化率高、无污染等特点,下图为Mg-NaClO燃料电池结构示意图,下列说法正确的是( )
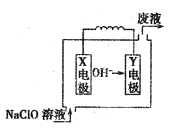
A. 镁作Y电极
B. 电池工作时,Na+向负极移动
C. 废液的pH大于NaClO溶液的pH
D. X电极上发生的反应为ClO-+2H2O - 4e-═ClO3-+4H+
科目:高中化学 来源: 题型:
【题目】化学在解决雾霾污染中有着重要的作用,雾霾由多种污染物形成,其中包含颗粒物PM2.5)、
氮氧化物(NOx)、CO、SO2等.
(1)已知:NO(g)+![]() O2(g)═NO2(g)△H=﹣56.5kJmol﹣1
O2(g)═NO2(g)△H=﹣56.5kJmol﹣1
2SO2(g)+O2(g)═2SO3(g)△H=﹣196.6kJmol﹣1
则反应NO2(g)+SO2(g)═SO3(g)+NO(g)△H=_________kJmol﹣1.
一定条件下,将NO2与SO2以物质的量比1:2置于恒温恒容的密闭容器中发生上述反应,
下列能说明反应达到平衡状态的有____________
a.混合气体的平均相对分子质量
b.混合气体颜色保持不变
c.SO3和NO的体积比保持不变
d.每消耗1mol SO3的同时生成1mol NO2
测得上述反应平衡时NO2与SO2物质的量比为1:3,则平衡常数K=________(用分数表示)
NH3催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术。在氨气足量的情况下,不同c(NO2)/c(NO),不同温度对脱氮率的影响如图所示(已知氨气催化还原氮氧化物的正反应为放热反应),请解释300℃之后脱氮率逐渐减小的原因:__________________________

(2)CO综合利用.
①CO用于合成甲醇反应方程式为:CO(g)+2H2(g)═CH3OH(g)
若起始投入1molCO,2mol H2,CO在不同温度下的平衡转化率与压强的关系如图所示.得知该反应的△H_________0,该反应的实际生产条件控制在 250 ℃、1.3×104kPa左右最为适宜.反应达平衡后,下列操作既能加快反应速率,又能使平衡混合物中CH3OH物质的量分数增大的是____________
a. 升温 b.恒容条件下充入H2
c.加入合适的正催化剂 d.恒容条件下再充入1molCO,2mol H2
e.压缩体积 f.移走一部分CH3OH
②电解CO制备CH4,电解质为碳酸钠溶液,工作原理如图2所示,写出阴极区电极
反应式_______________

(3)利用喷雾干燥法脱硫工艺是除去SO2的常见方法,先将含SO2的废气溶于水,再用饱和石灰浆吸收,具体步骤如下:
SO2(g)+H2O(l) ![]() H2SO3(l)
H2SO3(l) ![]() H+(aq)+HSO
H+(aq)+HSO![]() (aq) Ⅰ
(aq) Ⅰ
HSO![]() (aq)
(aq) ![]() H+(aq)+SO
H+(aq)+SO![]() (aq) Ⅱ
(aq) Ⅱ
Ca(OH)2(s) ![]() Ca2+(aq)+2OH-(aq) Ⅲ
Ca2+(aq)+2OH-(aq) Ⅲ
Ca2+(aq)+SO![]() (aq)
(aq) ![]() CaSO3(s) Ⅳ
CaSO3(s) Ⅳ
该温度下,测定吸收后液体中c(Ca2+)一直保持为0.70 mol/L,已知Ksp(CaSO3)=1.4×10-7,则吸收后溶液中的SO![]() 的浓度为_________________
的浓度为_________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将0.lmol某烃完全燃烧后的产物依次通过盛有浓硫酸和石灰水的广口瓶中浓硫酸的质量增加了 10.8g,盛有石灰水的广口瓶中产生了50g白色沉淀。
(1)通过计算确定该烃的分子式
(2)写出该烃所有可能的结构简式
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图在盛有水的烧杯中,铁圈和银圈的连接处吊着一根绝缘的细丝。小心地从烧杯中央滴入硫酸铜溶液

(1)片刻后可观察到的现象是(指悬吊的金属圈)(____)
A.铁圈和银圈左右摇摆不定 B.保持平衡状态不变
C.铁圈向下倾斜 D.银圈向下倾斜
(2)铁圈是___________极,发生的电极反应:__________________
银圈是__________极,发生的电极反应:__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】AF是几种烃分子的球棍模型(如下图所示),据此冋答下列问题:
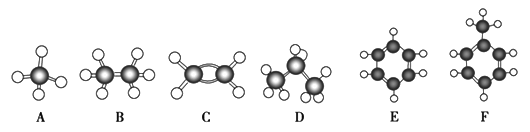
(1)含碳量最高的烃是(填对应字母)____________________
(2)能够发生加成反应的烃有(填对应字母)__________________
(3)写出F与液溴反应的化学方程式__________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关下列图像的分析正确的是
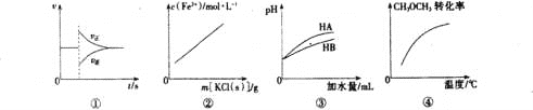
A. 图①可表示反N2(g)+3H2(g) ![]() 2NH3(g)在达到平衡后,臧少NH3的浓度,正逆反应速率的变化趋势
2NH3(g)在达到平衡后,臧少NH3的浓度,正逆反应速率的变化趋势
B. 图②表示FeCl3溶液和KSCN溶液反应达平衡后,向该混合液中逐渐加人固体KCl的过程中C(Fe3+)的变化趋势(忽略溶液体积变化)
C. 图③表示等体积等pH的弱酸HA和强酸HB加水稀释过程中的pH变化趋势
D. 图④表示密闭容器中CH3OCH3(g)+3H2O(g) ![]() 6H2(g)+2CO2(g) △H>0达到平衡后,恒压升高温度过程中,CH3OCH3的转化率变化趋势
6H2(g)+2CO2(g) △H>0达到平衡后,恒压升高温度过程中,CH3OCH3的转化率变化趋势
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图是铜与稀硝酸反应的两个实验装置图,请按要求回答问题:
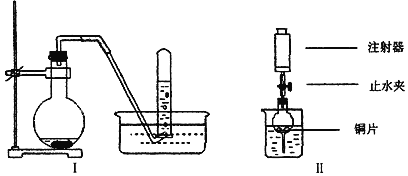
(1)铜与稀硝酸反应的离子方程式为_____________________________________________。
(2)I实验装置中能否证明铜与稀硝酸反应生成的是NO气体_______(选填“能”或“不能”), 简述理由_____________________________。
(3)若用Ⅱ实验装置进行实验,以证明铜与稀硝酸反应生成的气体是NO,则检查气密性的操作是______________________________________________________________________________。
(4)在Ⅱ实验装置的烧杯中加入一定体积的稀硝酸,打开止水夹,用注射器慢慢抽取干燥管内的空气,稀硝酸沿着干燥管慢慢上升,直到充满整个干燥管,停止抽拉注射器,关闭止水夹,此时观察干燥管内的现象是________________________________________;反应停止后,打开止水夹,用注射器抽取干燥管内的气体(事先已将注射器内原有的空气推出),关闭止水夹后取下注射器,并抽取一定量的空气,此时观察到的现象是____________________________________________。
(5)上述实验完成后,将注射器内的气体通入到NaOH溶液中,其目的是_______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com