
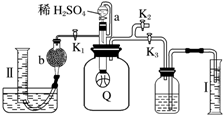
 为了测定已部分变质的过氧化钠样品的纯度,设计如图所示的实验装置,图中Q为弹性良好的气球(不与药品反应),称取一定量的样品放入其中.按如图所示的装置安装好仪器,打开分液漏斗的活塞,将稀硫酸滴入气球中.
为了测定已部分变质的过氧化钠样品的纯度,设计如图所示的实验装置,图中Q为弹性良好的气球(不与药品反应),称取一定量的样品放入其中.按如图所示的装置安装好仪器,打开分液漏斗的活塞,将稀硫酸滴入气球中.分析 (1)变质的过氧化钠中含有碳酸钠,加入酸后Q内发生反应:2Na2O2+2H2SO4=2Na2SO4+2H2O+O2↑;Na2CO3+H2SO4=Na2SO4+H2O+CO2↑,根据化合价变化判断氧化还原反应;
(2)反应产生的CO2、O2使气球变大,将广口瓶中气体排出,水进入量筒Ⅰ中,所以量筒Ⅰ中水的体积即为产生的CO2、O2
的体积;
(3)反应停止,打开K2,再缓缓打开K1,广口瓶内外相通,气球Q慢慢缩小;
(4)混合气体通过碱石灰吸收CO2,最后量筒Ⅱ中收集的是O2;
(5)根据化学方程式计算出碳酸钠、过氧化钠的质量并过氧化钠的纯度.
解答 解:(1)变质的过氧化钠中含有碳酸钠,加入酸后Q内发生反应:2Na2O2+2H2SO4=2Na2SO4+2H2O+O2↑;Na2CO3+H2SO4=Na2SO4+H2O+CO2↑,前者的氧元素的化合价发生了变化,是氧化还原反应,后者元素的化合价未变,是非氧化还原反应,
故答案为:2;1;
(2)反应产生的CO2、O2使气球变大,将广口瓶中气体排出,水进入量筒Ⅰ中,所以量筒Ⅰ中水的体积即为产生的CO2、O2的体积,所以滴稀H2SO4前必须关闭K1、K2打开K3,
故答案为:K1、K2;K3;
(3)反应停止,打开K2,再缓缓打开K1,广口瓶内外相通,气球Q慢慢缩小,
故答案为:气球Q慢慢缩小;
(4)混合气体通过碱石灰吸收CO2,最后量筒Ⅱ中收集的是O2,
故答案为:碱石灰;控制气体流速,使CO2充分吸收;
(5)2Na2O2+2H2SO4=2Na2SO4+2H2O+O2↑; Na2CO3 +H2SO4=Na2SO4+H2O+CO2↑,
$\frac{y×10{\;}^{-3}}{22.4}$×2 $\frac{y×10{\;}^{-3}}{22.4}$ $\frac{(x-y)×1{0}^{-3}}{22.4}$ $\frac{(x-y)×1{0}^{-3}}{22.4}$
则过氧化钠的质量为:$\frac{y×10{\;}^{-3}}{22.4}$×2×78,碳酸钠的质量为:$\frac{(x-y)×1{0}^{-3}}{22.4}$×106,
所以过氧化钠的纯度:$\frac{m(过氧化钠)}{m(过氧化钠)+m(碳酸钠)}$=$\frac{78y}{53x+25y}$,
故答案为:$\frac{78y}{53x+25y}$.
点评 本题考查混合物含量的测定,题目难度较大,本题要搞清量筒Ⅰ、Ⅱ的作用,根据反应的化学方程式计算即可解答.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 当消耗0.1 mol Zn时,得到的还原产物为0.1 mol | |
| B. | 反应结束时,可得到0.3 mol ZnSO4 | |
| C. | 当溶液中不再产生气泡时,溶液中大量存在的阳离子只有Zn2+ | |
| D. | 最后得到的金属单质为Cu |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaHCO3 | B. | Na2CO3 | C. | Ca(OH)2 | D. | NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用木材作燃料 | B. | 用柴油替代汽油 | C. | 把煤变成煤气 | D. | 开发风能 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 己烷的密度比水大,且难溶于水 | B. | 己烷在光照时能发生取代反应 | ||
| C. | 己烷在光照时能发生加成反应 | D. | 己烷不易燃烧,可作为灭火剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 电子方向:Zn→Cu | |
| B. | Cu电极逐渐溶解 | |
| C. | Zn电极上发生还原反应 | |
| D. | 盐桥中装有含氯化钾的琼脂,Cl-向右池移动 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com