
【题目】写出下列有机物的类别及所含官能团的名称。
(1)CH3CH=CH2____、_________;
(2)HC≡C—CH2CH3__________、__________;
(3)![]() _________、___________;
_________、___________;
(4)![]() _________、_________;
_________、_________;
(5)![]() _________、___________;
_________、___________;
(6)CH3CH2—O—CH3__________、__________。
 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案科目:高中化学 来源: 题型:
【题目】可逆反应①X(g)+2Y(g)![]() 2Z(g)、②2M(g)
2Z(g)、②2M(g)![]() N(g)+P(g)分别在密闭容器的两个反应室中进行,反应室之间有无摩擦、可滑动的密封隔板。反应开始和达到平衡状态时有关物理量的变化如图所示:
N(g)+P(g)分别在密闭容器的两个反应室中进行,反应室之间有无摩擦、可滑动的密封隔板。反应开始和达到平衡状态时有关物理量的变化如图所示:

其中平衡(Ⅰ)隔板在2.8处,平衡(Ⅱ)隔板在2.6处。
下列判断正确的是( )
A.反应①的正反应是吸热反应
B.达平衡(Ⅰ)时,X的转化率为5/6
C.在平衡(Ⅰ)和平衡(Ⅱ)中,M的体积分数相等
D.对于反应②,平衡(Ⅰ)时体系的压强与反应开始时体系的压强之比为10 :11
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X(g)+3Y (g)![]() 2W(g) +M (g) △H=-a kJ·mol-1(a>0)。一定温度下,在体积恒定的密闭容器中,加入1 mol X(g) 与2mol Y (g),下列说法正确的是( )
2W(g) +M (g) △H=-a kJ·mol-1(a>0)。一定温度下,在体积恒定的密闭容器中,加入1 mol X(g) 与2mol Y (g),下列说法正确的是( )
A.充分反应后,X的转化率和Y的转化率不相等,前者大于后者
B.当反应达到平衡状态时,W与M的物质的量浓度之比一定为2:1
C.当混合气体的密度不再改变,表明该反应已达平衡
D.若增大Y的浓度,正反应速率增大,逆反应速率减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C、D、E、F、G、H、I九种物质,其中A、B、D、E焰色反应均为紫色(透过蓝色钴玻璃),G、F是单质,其余均为化合物,H是一种淡黄色固体,它们的转化关系如图所示。请回答:
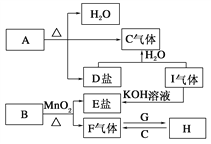
(1)画出G离子结构示意图________;
(2)写出B、I的化学式B________,I________;
(3)写出H的一种用途__________________________________;
(4)写出A受热分解的化学方程式_________________________;
(5)若10g的C6H12O6在氧气中充分燃烧,将产物全部与足量的H充分反应,反应后固体增重____________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取一定量的CuCl2产品投入Na2CO3溶液中,充分反应生得到一种仅含四种元素的不溶性盐X,并产生气体CO2。设计如下实验探究X的组成和性质。已知各步反应所需试剂均过量,请回答:

(1)混合气体的成分是______________;X的化学式为__________________。
(2)写出CuCl2与Na2CO3反应生成X的离子方程式______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用 0.1000 mol·L![]() NaOH溶液滴定 20.00mL0.1000 mol·L
NaOH溶液滴定 20.00mL0.1000 mol·L![]()
![]() 溶液所得滴定曲线如图。下列说法正确的是
溶液所得滴定曲线如图。下列说法正确的是
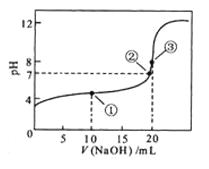
A.点①所示溶液中:![]()
B.点②所示溶液中:![]()
C.点③所示溶液中:![]()
D.滴定过程中可能出现:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下向10mL0.1mol/LNaOH溶液中加入0.1mol/L的一元酸HA,溶液pH的变化曲线如图所示。下列说法正确的是( )

A.a点溶液中:c(Na+)>c(A-)>c(H+)>c(HA)
B.a、c两点溶液中水的电离程度相同
C.b点溶液中:c(Na+)=c(A-)+c(HA)
D.c点溶液中:c(A-)>c(HA)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】弱电解质的电离平衡、盐类的水解平衡均属于化学平衡。根据要求回答问題。
(1)一定温度下,向1 L 0.1 mol·L-1CH3COOH溶液中加入0.1 mol CH3COONa固体,则醋酸的电离平衡向________(填“正”或“逆”)反应方向移动;水的电离程度将________(填“增大”、“减小”或“不变”)。
(2)99℃时,KW=1.0×10-12 mol2·L-2,该温度下测得0.1 mol·L-1Na2A溶液的pH=6。
①H2A在水溶液中的电离方程式为______。
②体积相等、pH=1的盐酸与H2A溶液分别与足量的Zn反应,产生的氢气_____。
A.盐酸多 B.H2A多 C.一样多 D.无法确定
③将0.1 mol·L-1H2A溶液与0.2 mol·L-1氨水等体积混合,完全反应后溶液中各离子浓度的电荷守恒关系式为__________。
(3)已知常温下,H2SO3的电离常数为Kal=1.54×10-2,Ka2=1.02×10-7,H2CO3的电离常数为Kal=4.30×10-7,Ka2=5.60×10-11。
①下列微粒可以大量共存的是________(填字母)。
a.![]() 、
、![]() b.
b.![]() 、
、![]() c.
c.![]() 、
、![]() d.H2SO3、
d.H2SO3、![]()
②已知NaHSO3溶液显酸性,溶液中各离子浓度从大到小的排列顺序是_______。
(4)0.1 mol·L-1的NaHA溶液,测得溶液显碱性。则该溶液中 c(H2A)________c(A2-)(填“>”、“<”或“=”),作出此判断的依据是__________(用文字解释)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,向 2.0 L恒容密闭容器中充入1.0 mol PCl5,反应PCl5(g)PCl3(g)+Cl2(g)经过一段时间后达到平衡。反应过程中测定的部分数据见下表。下列说法正确的是( )
t/s | 0 | 50 | 150 | 250 | 350 |
n(PCl3)/mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
A.反应在前 50 s 的平均速率v(PCl3)=0.0032 mol·L1·s1
B.该条件下,反应的平衡常数K=0.05
C.保持其他条件不变,升高温度,平衡时c(PCl3)=0.11 mol·L1,则反应的ΔH<0
D.其他条件相同时,向空的容器中充入1.0 mol PCl5、0.20 mol PCl3和0.20 mol Cl2,此时 v(正)>v(逆)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com