
| A. | 无法计算 | B. | 77.8% | C. | 84.1% | D. | 81.4% |
分析 Fe、FeO、Fe2O3的混合物中加入盐酸恰好使混合物完全溶解,生成了铁的氯化物,因加入KSCN 溶液,无血红色出现,说明只生成氯化亚铁,根据氯元素守恒可知道氯化亚铁的量,进而求得铁元素的质量,根据HCl的物质的量可结合氢气的物质的量可计算O的质量,进而可计算 混合物中铁元素的质量分数.
解答 解:用盐酸溶解后,得到的产物加 KSCN 溶液,无血红色出现,说明得到的产物是氯化亚铁,即混合物中的铁元素全在氯化亚铁中,
盐酸的物质的量为:1mol.L-1×0.1L=0.1mol,
根据氯元素守恒,则n(Fe)=n(FeCl2)=$\frac{1}{2}$×n(HCl)=0.05mol,
m(Fe)=0.05mol×56g/mol=2.8g,
根据H元素守恒,有2HCl$\stackrel{FexOy}{→}$H2O,2HCl$\stackrel{Fe}{→}$H2,
生成氢气的物质的量为:n(H2)=$\frac{0.224L}{22.4L/mol}$=0.01mol,消耗HCl的物质的量为:0.01mol×2=0.02mol,
则与氧化物反应的HCl的物质的量为:0.1mol-0.02mol=0.08mol,
所以氧化物中含有n(O)=$\frac{0.08mol}{2}$=0.04mol,
m(O)=0.04mol×16g/mol=0.64g,
则混合物中铁元素的质量分数为:$\frac{2.8g}{2.8g+0.64g}$=81.4%,
故选D.
点评 本题考查了混合物反应的计算,题目难度中等,明确发生反应的原理为解答关键,采用原子守恒或得失电子守恒可简化计算,试题培养了学生的化学计算能力.


科目:高中化学 来源: 题型:选择题
| A. | 高温下,16.8g Fe与足量水蒸气完全反应失去电子数为0.8 NA | |
| B. | 12g NaHSO4固体中阴离子所带负电荷数为0.02 NA | |
| C. | 1 mol OD-含有的质子、中子、电子数均为9NA | |
| D. | 含4 NA个离子的固体Na2O2溶于水配成1L溶液,所得溶液中c(Na+)=2 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 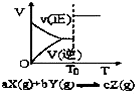 密闭容器中反应达到平衡,T0时改变某一条件有如图变化所示,则改变的条件一定是加入催化剂 | |
| B. | 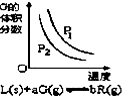 反应达到平衡时,外界条件对平衡影响关系如图所示,则正反应为放热反应,且a>b | |
| C. | 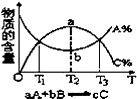 物质的百分含量和温度关系如图所示,则该反应的正反应为吸热反应 | |
| D. | 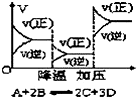 反应速率和反应条件变化关系如图所示,则该反应的正反应为放热反应,A、B、C是气体、D为固体或液体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铝粉投入到NaOH溶液中:2Al+2OH-═2AlO2-+H2↑ | |
| B. | 过量Ba(OH)2溶液与少量的NaHCO3溶液混合Ba2++2OH-+2HCO3-═BaCO3↓+CO32-+2H2O | |
| C. | 石英溶于NaOH溶液:Si4++2O2-+2OH-=SiO32-+H2O | |
| D. | 硅酸钠溶液中滴加盐酸:SiO32-+2H+═H2SiO3↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 化学实验现象 | 解释与结论 | |
| A | 钠与水反应时浮在水面上 | 钠与水生成的气体托举钠浮在水面上 |
| B | 铁与氯气反应剧烈燃烧产生红棕色的烟 | 产物为红棕色小颗粒,燃烧不一定需要氧气 |
| C | 氯水呈黄绿色 | 氯气与水反应生成了黄绿色物质 |
| D | 氢气在氯气中燃烧时瓶口有白雾 | 氯气逸出结合空气中的水蒸气而呈白雾状 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②⑤ | B. | ②⑤⑥ | C. | ③④ | D. | 只有⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | +16.3 | B. | -16.3 | C. | +335.7 | D. | -335.7 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com