
在某温度下,将2 mol A和3 mol B充入一密闭容器中,发生反应:aA(g)+B(g)C(g)+D(g),5 mi n后达到平衡,已知各物质的平衡浓度
n后达到平衡,已知各物质的平衡浓度 的关系为ca(A)·c(B)=c(C)·c(D)。若在温度不变的情况下,将容器的体积扩大为原来的10倍,A的转化率没有发生变化,则B的转化率为( )
的关系为ca(A)·c(B)=c(C)·c(D)。若在温度不变的情况下,将容器的体积扩大为原来的10倍,A的转化率没有发生变化,则B的转化率为( )
A.60% B.40%
C.24% D.4%
科目:高中化学 来源: 题型:
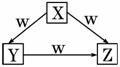
X、Y、Z、W是中学化学常见的四种物质,它们之间具有如图所示转化关系,则下列组合不可能的是( )
| X | Y | Z | W | |
| A | C | CO | CO2 | O2 |
| B | Na | Na2O | Na2O2 | O2 |
| C | AlCl3 | Al(OH)3 | Na[Al(OH)4] | NaOH |
| D | Fe | FeCl2 | FeCl3 | Cl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
在一个不导热的密闭反应器中,只发生两个反应:
a(g)+b(g)2c(g) Δ H1<0
H1<0
x(g)+3y(g)2z(g) ΔH2>0
进行相关操作且达到平衡后(忽略体积改变所做的功),下列叙述错误的是( )
A.等压时,通入惰性气体,c的物质的量不变
B.等压时,通入z气体,反应器中温度升高
C.等容时,通入惰性气体,各反应速率不变
D.等容时,通入z气体,y的物质的量浓度增大
查看答案和解析>>
科目:高中化学 来源: 题型:
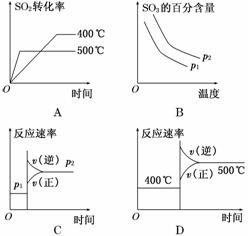
可逆反应2SO2(g)+O2(g)2SO3(g),根据下表中的数据判断下列图像错误的是( )
| 压强
温度 | p1(MPa) | p2(MPa) |
| 400℃ | 99.6 | 99.7 |
| 500℃ | 96.9 | 97.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:
化学平衡常数(K)、弱酸的电离平衡常数(Ka)、难溶物的溶度积常数(Ksp)是判断物质性质或变化的重要的平衡常数。下列关于这些常数的说法中,正确的是( )
A.平衡常数的大小与温度、浓度、压强、催化剂等有关
B.当温度升高时,弱酸的电离平衡常数Ka变小
C.Ksp(AgCl) > Ksp(AgI) ,由此可以判断AgCl(s) + I-(aq)===AgI(s)+ Cl-(aq)能够发生
D.Ka(HCN) < Ka(CH3COOH) ,说明物质的量浓度相同时,氢氰酸的酸性比醋酸强
查看答案和解析>>
科目:高中化学 来源: 题型:
在t℃时,AgBr在水中的沉淀溶解平衡曲线如图所示。又知t℃时AgCl的Ksp=4×10-10。下列说法不正确的是( )
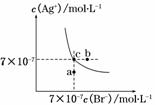 A.在t℃时,AgBr的Ksp为4.9×10-13
A.在t℃时,AgBr的Ksp为4.9×10-13
B.在AgBr饱和溶液中加入NaBr固体,可使溶液由c点到b点
C.图中a点对应的是AgBr的不饱和溶液
D.在t℃时,AgCl(s)+Br-(aq)AgBr(s)+Cl-(aq)平衡常数K≈816
查看答案和解析>>
科目:高中化学 来源: 题型:
硫酸是强酸,中学阶段将硫酸在水溶液中看做完全电离。但事实是,硫酸在水中的第一步电离是完全的,第二步电离并不完全,其电离情况为H2SO4===H++HSO ,HSO
,HSO H++SO
H++SO 。
。
请回答下列有关问题:
(1)Na2SO4溶液 呈________(填“弱酸性”、“中性”或“弱碱性”),其理由是
呈________(填“弱酸性”、“中性”或“弱碱性”),其理由是
_____________________________________________________________。
(用离子方程式表示)。
(2)H2SO4溶液与BaCl2溶液反应的离子方程式为________
________________________________________________________________________。
(3)在0.10 mol·L-1的Na2SO4溶液中,下列离子浓度的关系正确的是________(填写编号)。
A.c(Na+)=c(SO )+c(HSO
)+c(HSO )+c(H2SO4)
)+c(H2SO4)
B.c(OH-)=c(HSO )+c(H+)
)+c(H+)
C.c(Na+)+c(H+)=c(OH-)+c(HSO )+2c(SO
)+2c(SO )
)
D.c(Na+)=2c(SO )+2c(HSO
)+2c(HSO )
)
(4)若25℃时,0.10 mol·L-1的NaHSO4溶液中c(SO )=0.029 mol·L -1,则0.10 mol·L-1的H2SO4溶液中c(SO
)=0.029 mol·L -1,则0.10 mol·L-1的H2SO4溶液中c(SO )________0.029 mol·L-1(填“<”、“>”或“=”),其理由是
)________0.029 mol·L-1(填“<”、“>”或“=”),其理由是
________________________________________________________________________
________________________________________________________________________。
(5)或25℃时,0.10 mol·L-1H2SO4溶液的pH=-lg 0.11,则0.10 mol·L-1H2SO4溶液中c(SO )=________ mol·L-1。
)=________ mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知溶液中存在下列离子,试判断该溶液的溶质并写出其电离方程式:
(1)H+、Cl-__________________________________________。
(2)Fe3+、SO _____________________________________________。
_____________________________________________。
(3)Na+、HCO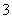 __________________________________________________。
__________________________________________________。
(4)NH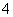 、NO
、NO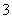 _______________________________________________。
_______________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com