
| A. | v (X)正=v (X)逆=0 | |
| B. | v (X):v (Y)=l:2 | |
| C. | 容器内X、Y、Z的浓度不随时间变化 | |
| D. | 单位时间消耗0.1 molX同时生成0.2molZ |
分析 可逆反应达到平衡状态时,正逆反应速率相等(同种物质)或正逆反应速率之比等于系数之比(不同物质),平衡时各种物质的物质的量、浓度等不再发生变化,由此衍生的一些物理量不变,以此分析解答.
解答 解:A、反应达到平衡时,v (X)正=v (X)逆≠0,是一种动态平衡,故A错误;
B、反应进行到任意状态,速率之比等于物质前边的系数之比,所以v (X):v (Y)=l:2的状态不一定平衡,故B错误;
C、反应前后气体物质的量不同,所以压强不变说明各组分浓度不变,反应到达平衡状态,故C正确;
D、单位时间消耗0.1molX同时生成0.2molZ,说明反应v正(X)=2v正(Y),不能说明达平衡,故D错误;
故选C.
点评 在利用速率判断平衡时,必须有v正和v逆,同种物质相等,不同物质等于系数之比,题目难度不大.


科目:高中化学 来源: 题型:解答题
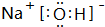 .
.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
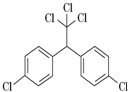 DDT又叫滴滴涕,化学名为双对氯苯基三氯乙烷,化学式(ClC6H4)2CH(CCl3).名称从英文缩写DDT而来,为白色晶体,不溶于水,溶于煤油,可制成乳剂,是有效的杀虫剂.DDT进入食物链,是导致一些食肉和食鱼的鸟接近灭绝的主要原因.因此从70年代后滴滴涕逐渐被世界各国明令禁止生产使用.其结构如图,下列有关说法正确的是( )
DDT又叫滴滴涕,化学名为双对氯苯基三氯乙烷,化学式(ClC6H4)2CH(CCl3).名称从英文缩写DDT而来,为白色晶体,不溶于水,溶于煤油,可制成乳剂,是有效的杀虫剂.DDT进入食物链,是导致一些食肉和食鱼的鸟接近灭绝的主要原因.因此从70年代后滴滴涕逐渐被世界各国明令禁止生产使用.其结构如图,下列有关说法正确的是( )| A. | DDT属于烃类 | |
| B. | DDT完全燃烧后只产生CO2和H2O两种物质 | |
| C. | DDT分子中无手性碳原子 | |
| D. | 氢核磁共振谱图中有3种位置峰 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 单质能与水反应生成强碱的金属元素都在ⅠA族 | |
| B. | L层上的电子数为奇数的元素一定是主族元素 | |
| C. | 稀有气体元素原子的最外层电子数均为8 | |
| D. | 元素周期表有18个纵行,分列16个族,即7个主族、8个副族和一个零族 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
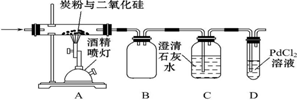
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CS2为V形的极性分子 | B. | ClO3-的空间构型为平面三角形 | ||
| C. | SF6中有6对完全相同的成键电子对 | D. | SiF4和SO3的中心原子均为sp2杂化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 增加某一反应物的用量一定能够加快该反应的速率 | |
| B. | 化学反应的限度是不可改变的 | |
| C. | 化学反应进行的时间越长该反应的限度越大 | |
| D. | 化学反应达到限度时,正逆反应速率相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
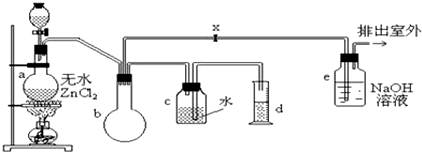
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com