
| 1 |
| 4 |
| 250mL |
| 25mL |
| 0.005mol×143g/mol |
| 2.0g |


 导学全程练创优训练系列答案
导学全程练创优训练系列答案科目:高中化学 来源: 题型:
| A、①③ | B、①④ | C、②③④ | D、②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
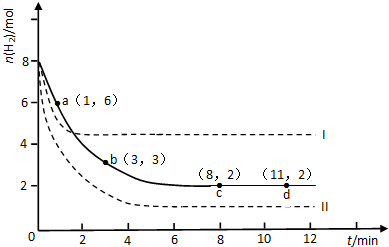
查看答案和解析>>
科目:高中化学 来源: 题型:
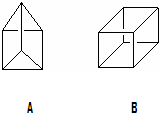 有机物A和B都是重要的化工原料,认真观察A和B的结构回答下列问题:
有机物A和B都是重要的化工原料,认真观察A和B的结构回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
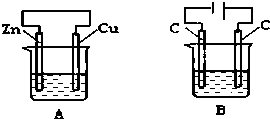 仔细观察图A、B两个装置,两个烧杯分别盛有足量的CuSO4溶液,回答问题:
仔细观察图A、B两个装置,两个烧杯分别盛有足量的CuSO4溶液,回答问题:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com