
| A. | 化学反应除了生成新的物质外,还伴随着能量的变化 | |
| B. | 物质燃烧不一定是放热反应 | |
| C. | 放热的化学反应不需要加热就能发生 | |
| D. | 吸热反应不加热就不会发生 |
科目:高中化学 来源: 题型:实验题
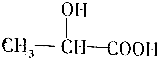 ,
,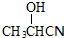 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4甲基4,5二乙基己烷 | B. | 2,3-二甲基-2,4-戊二烯 | ||
| C. | CH3CH(OH)CH2CH3:丁醇 | D. | 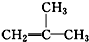 :2-甲基-1-丙烯 :2-甲基-1-丙烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 简单离子半径:X<Y<W | |
| B. | Y、Z两种元素的氧化物均具有两性 | |
| C. | X、W分别形成的氢化物中所含化学键种类相同 | |
| D. | Z、W形成化合物的电子式为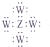 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |
| 4 | ⑩ | ⑪ | ⑫ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
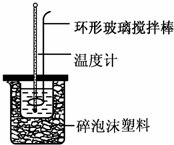 实验室用50mL 0.50mol•L-1盐酸、50mL 0.55mol•L-1 NaOH溶液和如图所示装置,进行测定中和热的实验,得到表中的数据:
实验室用50mL 0.50mol•L-1盐酸、50mL 0.55mol•L-1 NaOH溶液和如图所示装置,进行测定中和热的实验,得到表中的数据:| 实验次数 | 起始温度t1/℃ | 终止温度t2/℃ | |
| 盐酸 | NaOH溶液 | ||
| 1 | 20.2 | 20.3 | 23.7 |
| 2 | 20.3 | 20.5 | 23.8 |
| 3 | 21.5 | 21.6 | 24.9 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 苯乙烯是生产塑料和合成橡胶的重要基本有机原料,乙苯催化脱氢法是目前国内外生产苯乙烯的主要方法,其化学方程式为:
苯乙烯是生产塑料和合成橡胶的重要基本有机原料,乙苯催化脱氢法是目前国内外生产苯乙烯的主要方法,其化学方程式为: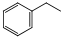 (g)$?_{高温(T)}^{Fe_{2}O_{3}}$
(g)$?_{高温(T)}^{Fe_{2}O_{3}}$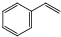 (g)+H2(g)△H=+120kJ•mol-1
(g)+H2(g)△H=+120kJ•mol-1查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe2O3+3CO=2Fe+3CO2△H=-28.5kJ•mol-1( ) | |
| B. | Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=-28.5kJ | |
| C. | Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=+28.5kJ•mol-1 | |
| D. | Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=-28.5kJ•mol-1. |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com