
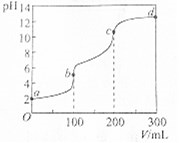
 室温下,向100mL一定浓度的草酸(H2C2O4)溶液中加入0.1mol•L-1 NaOH溶液的pH随NaOH溶液体积的变化曲线如图所示.下列有关说法正确的是( )
室温下,向100mL一定浓度的草酸(H2C2O4)溶液中加入0.1mol•L-1 NaOH溶液的pH随NaOH溶液体积的变化曲线如图所示.下列有关说法正确的是( )| A. | a点溶液的pH=2,草酸溶液的浓度为0.005mol•L-1 | |
| B. | b点对应溶液中:c(Na+)>c(HC2O4-)>c(OH-)>c(C2O42-) | |
| C. | b→c段,反应的离子方程式为HC2O4-+OH-═C2O42-+H2O | |
| D. | c→d段,溶液中C2O42-的水解程度逐渐增强 |
分析 A.加入200mL等浓度的氢氧化钠溶液时,反应后溶质为Na2C2O4,溶液的pH>7,证明为H2C2O4弱酸;
B.b点反应后溶质为NaHC2O4,溶液呈酸性说明HC2O4-的电离程度大于其水解程度,则c(C2O42-)>c(OH-);
C.b点溶质为NaHC2O4,b→c段草酸氢根离子与氢离子反应生成草酸;
D.c点溶质为Na2C2O4,c→d段氢氧化钠过量,氢氧根离子抑制了草酸根离子的水解.
解答 解:A.点溶液的pH=2,草酸溶液中氢离子浓度为0.01mol•L-1,由于加入200mL等浓度的氢氧化钠溶液时混合液的pH>7,证明为H2C2O4弱酸,则草酸的浓度大于0.005mol/L,故A错误;
B.b点对应溶液中溶质为NaHC2O4,此时溶液的pH<7,说明HC2O4-的电离程度大于其水解程度,则c(C2O42-)>c(OH-),溶液中正确的离子浓度大小为:c(Na+)>c(HC2O4-)>c(C2O42-)>c(OH-),故B错误;
C.b点对应溶液中溶质为NaHC2O4,则b→c段发生反应的离子方程式为:HC2O4-+OH-═C2O42-+H2O,故C正确;
D.c→d段随着NaOH的加入,氢氧根离子浓度增大,抑制了C2O42-的水解,溶液中C2O42-的水解程度逐渐减弱,故D错误;
故选C.
点评 本题考查溶液酸碱性与溶液pH的关系,题目难度中等,涉及酸碱中和反应、盐的水解原理、溶液pH计算、离子浓度大小比较等知识,明确各点溶质组成为解答关键,注意掌握溶液酸碱性与溶液pH的关系.


 手拉手全优练考卷系列答案
手拉手全优练考卷系列答案科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 1915年诺贝尔物理学奖授予HenryBragg和LawrenceBragg,以表彰他们用X射线对晶体结构的分析所作的贡献.
1915年诺贝尔物理学奖授予HenryBragg和LawrenceBragg,以表彰他们用X射线对晶体结构的分析所作的贡献.| 晶体 | NaCl | KC1 | CaO |
| 晶格能/(kJ•mol-1) | 786 | 715 | 3401 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 ,下列关系不正确的是( )
,下列关系不正确的是( )| A. | 原子半径:K>Ga>Al | B. | 碱性:KOH>Ga(OH)3>Al(OH) 3 | ||
| C. | 离子的氧化性:K+>Ga3+>Al3+ | D. | 与水反应的剧烈程度:K>Ga>Al |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 描述一 | 描述二 | |
| A | 淀粉和纤维素互为同分异构体 | 乙酸和乙酸乙酯互为同系物 |
| B | 金刚石和石墨互为同素异形体 | O2和O3互为同位素 |
| C | SO2和NO2都属于大气污染物 | pH小于7的雨水就属于酸雨 |
| D | 正反应活化能小于逆反应活化能的反应属于放热反应 | 反应物能量总和大于生成物能量总和的反应属于放热反应 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com