
| ||
| ||


 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案科目:高中化学 来源: 题型:
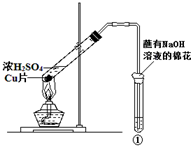 用如图所示装置进行实验,下列对实验现象的解释不合理的是( )
用如图所示装置进行实验,下列对实验现象的解释不合理的是( )| ①中试剂 | ①中现象 | 解 释 | |
| A | Ba(NO3)2溶液 | 生成白色沉淀 | SO32-与Ba2+生成白色BaSO3沉淀 |
| B | 品红溶液 | 溶液褪色 | SO2具有漂白性 |
| C | 紫色石蕊溶液 | 溶液变红 | SO2与水反应生成酸 |
| D | 酸性KMnO4溶液 | 紫色褪去 | SO2具有还原性 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
 科学家预言,燃料电池是21世纪获得电能的重要途径.一种甲烷燃料电池是采用铂作电极催化剂,电池中的质子交换膜只允许质子和水分子通过.其工作原理的示意图如下:
科学家预言,燃料电池是21世纪获得电能的重要途径.一种甲烷燃料电池是采用铂作电极催化剂,电池中的质子交换膜只允许质子和水分子通过.其工作原理的示意图如下:查看答案和解析>>
科目:高中化学 来源: 题型:
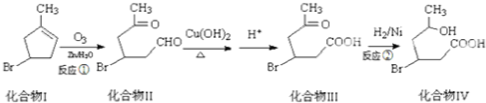
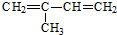 (2-甲基-1,3-丁二烯)发生类似①的反应,得到有机物Ⅵ和VⅡ,结构简式分别是为
(2-甲基-1,3-丁二烯)发生类似①的反应,得到有机物Ⅵ和VⅡ,结构简式分别是为查看答案和解析>>
科目:高中化学 来源: 题型:
 Ⅰ化学是一门以实验为主的科学,化学实验是学习探究物质性质的基本方法之一.
Ⅰ化学是一门以实验为主的科学,化学实验是学习探究物质性质的基本方法之一.查看答案和解析>>
科目:高中化学 来源: 题型:
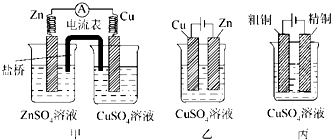
查看答案和解析>>
科目:高中化学 来源: 题型:
 开发使用清洁能源,发展“低碳经济”正成为科学家研究的主要课题.氢气、甲醇是优质的清洁燃料,可制作燃料电池.
开发使用清洁能源,发展“低碳经济”正成为科学家研究的主要课题.氢气、甲醇是优质的清洁燃料,可制作燃料电池.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CaO能与SO2反应,CaO可作工业废气的脱硫剂 |
| B、同浓度的Na2CO3溶液在不同温度下的去污能力不同 |
| C、加热能杀死流感病毒是因为病毒的蛋白质受热变性 |
| D、明矾水解时产生具有吸附性的胶体粒子,可作漂白剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.1mol?L-1的KA1(SO4)2溶液中:c(SO42-)>c(K+)>c(A13+)>c(H+)>c(OH-) |
| B、10mL 0.01mo1?L-1HCl溶液与10mL 0.01mo1?L-1 Ba(OH)2溶液充分混合,若混合后溶液的体积为20mL,则溶液的pH=12 |
| C、在0.1mol?L-1CH3COONa溶液中,c(OH-)=c(CH3COOH)+c(H+) |
| D、等体积、等物质的量浓度的NaX和弱酸HX混合后的溶液,若溶液呈酸性,则有c(Na+)>c(HX)>c(X-)>c(H+)>c(OH-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com