
在下图所示装置中,试管A、B中的电极为多孔的惰性电极;C、D为两个铂夹夹在被Na2SO4溶液浸湿的滤纸条上,滤纸条的中部滴有KMnO4液滴;电源有a、b两极。若在A、B中充满KOH溶液后倒立于盛KOH溶液的水槽中,断开K1,闭合K2、K3,通直流电,实验现象如图所示,请回答下列问题:
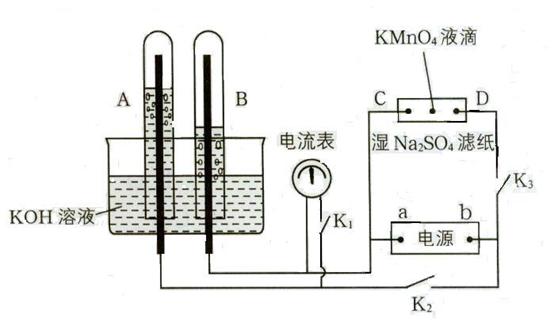
⑴标出电源的正、负极:a为 极,b为 极。
⑵在湿的Na2SO4滤纸条的中部KMnO4液滴处发生的现象为 。
⑶若电解一段时间后,A、B中均有气体包围电极。此时切断K2、K3,闭合K1,则电流表的指针 (填是或否)偏转,其理由是
。
⑷若电流表的指针发生偏转,请写出有关的电极反应式:A中 ;
B中 (若指针不发生偏转,则此题不需要回答)。若指针不发生偏转,请说明理由 (若指针发生偏转,则此题不需要回答)。
⑴负极 正极;⑵紫红色的KMnO4液滴向D极移动;⑶是 切断K2、K3,闭合K1,则由B中的H2与电极,A中的O2与电极,和KOH溶液组成氢氧燃料电池,将化学转化为电能,所以,电流表的指针发生偏转;⑷O2 + 2H2O + 4![]() → 4
→ 4![]() H2+2OH- → 2H2O+2e-。
H2+2OH- → 2H2O+2e-。
⑴电解KOH溶液实质是电解水,所得的产物是H2和O2,因为B中的气体的体积是A中气体体积的2倍,所以B中为H2,A中为O2,即A为阳极,B为阴极, 所以a为负极,b为正极。⑵a为负极,b为正极,D为阳极,C为阴极,湿的Na2SO4滤纸条相当于电解池,阴离子向阳极移动,故紫红色的KMnO4液滴向D极移动;⑶切断K2、K3,闭合K1,则由B中的H2,A中的O2,与KOH溶液组成氢氧燃料电池,将化学转化为电能,所以,电流表的指针发生偏转;⑷组成原电池A为正极,电极反应式:O2 + 2H2O + 4![]() → 4
→ 4![]() ,B为负极,电极反应式:H2+2OH- → 2H2O+2e-。
,B为负极,电极反应式:H2+2OH- → 2H2O+2e-。


 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案科目:高中化学 来源: 题型:



查看答案和解析>>
科目:高中化学 来源:志鸿系列训练必修一化学人教版 人教版 题型:058
在下图所示装置中,烧瓶中充满气体A.打开弹簧夹,将滴管中液体B挤入烧瓶内,烧杯中液体与B相同,轻轻振荡烧瓶,尖嘴管有液体呈喷泉状喷出,最终几乎充满烧瓶.
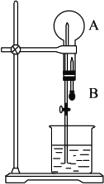
(1)若A为HCl气体,B为石蕊试液,则形成红色喷泉.试分析红色喷泉形成的原因________________.
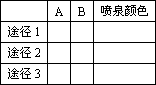
(2)根据喷泉形成的原理,选择适当的A和B来完成喷泉实验(至少通过两种途径且其中一种喷泉为有色),将你的选择填入下表:
查看答案和解析>>
科目:高中化学 来源:2013-2014学年河北衡水中学高三上学期期中考试化学试卷(解析版) 题型:填空题
(一)、某市对大气进行监测,发现该市首要污染物为可吸入颗粒物PM2.5(直径小于等于2.5um的悬浮颗粒物)其主要来源为燃煤、机动车尾气等。因此,对PM2.5、SO2、NOx等进行研究具有重要意义。请回答下列问题:
(1)对PM2.5样本用蒸馏水处理制成待测试样。若测得该试样所含水溶性无机离子的化学组分及其平均浓度如下表:
|
离子 |
K+ |
Na+ |
NH4+ |
SO42- |
NO3- |
Cl- |
|
浓度/mol.L |
4x10ˉ6 |
6x 10ˉ6 |
2x10ˉ5 |
4x10ˉ5 |
3x10ˉ5 |
2x10ˉ5 |
根据表中数据判断PM2.5为 , (填“酸性”、“中性”或“碱性”)
(2)为减少SO2的排放,常采取的措施有:将煤转化为清洁气体燃料。已知:
H2(g)+1/2O2(g)=H2O(g)
 H= -241.8KJ/mol C(s)+1/2O2(g)=CO(g)
H= -241.8KJ/mol C(s)+1/2O2(g)=CO(g)
 H= -110.5KJ/mol
H= -110.5KJ/mol
写出焦炭与水蒸气反应的热化学方程式
(3)洗涤含SO2的烟气,以下物质可作洗涤剂的是 (填编号)
a.Ca(OH)2 b.Na2CO3 c.CaCl2 d.NaHSO3
(二)A、B、C、D、E五种短周期元素(A、B、C、D、E分别代表元素符号),它们的原子序数依次增大;A是元素周期表中原子半径最小的元素;B元素最高价氧化物对应的水化物与其氢化物反应生成一种盐X;D与A同主族,且与E同周期;E元素原子的最外层电子数是其次外层电子数的=3/4倍;C与E同主族。
请回答下列问题:
(1)X的化学式______
(2)下列各项中,能说明元素C比E非金属性强的事实有______(填序号)。
①氢化物H2E的酸性比H2C强
②氢化物H2C的热稳定性比H2E强
③氢化物H2E的水溶液放置在空气中会变浑浊
④C与E组成化合物,C显负价
(3) 将由BC和BC2组成的混合气体通入下图所示装置中,用来验证浓硝酸的氧化性比稀硝酸的氧化性强。

已知(ⅰ)浓硝酸能将气体BC氧化成BC2,而稀硝酸不能氧化BC。
(ⅱ)NaOH溶液与BC2反应的化学方程式为:
2NaOH+2BC2=NaBC2+NaBC+H2O
NaOH溶液与BC气体不反应装置②、③中盛放的药品依次是______、______。
(4)通入混合气体之前,应先通入一段时间某另外一种气体,试推测先通入的该气体可以是______(填一种气体的化学式)。
查看答案和解析>>
科目:高中化学 来源:2013届安徽省蚌埠市高二第二学期期中联考试化学试卷(解析版) 题型:填空题
10分) 如下图所示装置中,b电极用金属M制成,a、c、d为石墨电极,接通电源,金属M沉积于b极,同时a、d电极上产生气泡。试回答:

(1)a为 极
(2)电解开始时,在B烧杯的中央滴几滴淀粉溶液,你能观察到的现象是 ;电解进行一段时间后,罩在c极上的试管中也收集到了气体,此时c极上的电极反应为: 。
(3)当d电极上收集到44.8 ml气体(标准状况)时停止电解,a极上放出了 ml气体,若b电极上沉积金属M的质量为0.432g,则此金属的摩尔质量为 g·moL-1。
查看答案和解析>>
科目:高中化学 来源:同步题 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com