
| A. | 向1mol•L-1的氨水中加少里硫酸铵固体,则溶液中$\frac{c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$减小 | |
| B. | 物质的量浓度相等的①(NH4)2SO4溶液②NH4HCO3溶液③NH4Cl溶液④(NH4)2Fe(SO4)2溶液液中,c(NH${\;}_{4}^{+}$)的大小关系:④>①>③>② | |
| C. | 将2mol•L-1的某一元酸HA溶液和1mol•L-1 NaOH溶液等体积混合后溶液pH大于7,则反应后的混合液:c(OH-)+c(A-)=c(H+)+c(HA) | |
| D. | 物质的量浓度之比为 1:1 的NaClO、NaHCO3混合溶液中:c(HC10)+c(ClO-)=c(C0${\;}_{3}^{2-}$)+c(HCO${\;}_{3}^{-}$)+c(H2CO3) |
分析 A.向氨水中加入少量硫酸铵固体,铵根离子浓度增大,抑制氨水的电离,溶液中氢氧根离子浓度减小,氨水分子浓度增大;
B.①(NH4)2SO4 ②NH4HCO3 ③NH4Cl ④NH4Fe(SO4)2先不考虑水解,则①(NH4)2SO4含有两个NH4+,所以它们NH4+的浓度大于其它三种物质,溶液中c(NH4+)根据盐类水解的影响分析判断;
C.溶液中电荷守恒和物料守恒就是来分析判断;
D.物质的量浓度之比为 1:1 的NaClO、NaHCO3混合溶液中存在氯元素和碳元素的物料守恒分析.
解答 解:A.由于(NH4)2SO4=2NH4++SO42-,溶液中NH4+浓度增大,抑制氨水电离,导致溶液中氢氧根离子浓度减小,氨水分子浓度增大,所以此时溶液中液$\frac{c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$减小,故A正确;
B.物质的量浓度相同的下列溶液:①(NH4)2SO4 ②NH4HCO3 ③NH4Cl ④(NH4)2Fe(SO4)2;先不考虑水解,①(NH4)2SO4、④(NH4)2Fe(SO4)2中含有两个NH4+,所以它们NH4+的浓度大于其它两种物质,①④二种物质中,④NH4Fe(SO4)2酸性最强,NH4+水解受到的抑制最大,即NH4+的量较多,溶液中c(NH4+)较大,①<④,②NH4HCO3 ③NH4Cl,NH4+水解,②NH4HCO3,碳酸氢根离子的水解对铵根离子起促进作用,即溶液中c(NH4+)③>②,按c(NH4+)由大到小的顺序排列为:④>①>③>②,故B正确;
C.将2mol•L-1的某一元酸HA溶液和1mol•L-1 NaOH溶液等体积混合后溶液pH大于7,得到等浓度的HA和NaA混合溶液,溶液中存在电荷守恒:c(OH-)+c(A-)=c(H+)+c(Na+),物料守恒2c(Na+)=c(A-)+c(HA),则反应后的混合液:2c(OH-)+c(A-)=2c(H+)+c(HA),故C错误;
D.物质的量浓度之比为 1:1 的NaClO、NaHCO3混合溶液中存在物料守恒n(Cl)=n(C),氯元素所有存在形式和碳元素的所有存在形式:c(HC10)+c(ClO-)=c(C032-)+c(HCO3-)+c(H2CO3),故D正确;
故选C.
点评 本题考查了电解质溶液中离子浓度大小、物料守恒、电荷守恒等知识点的理解应用,题目难度中等.


 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案科目:高中化学 来源: 题型:选择题
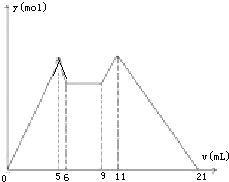 如图是向MgCl2、AlCl3混合溶液中,开始滴加6ml试剂A,之后改滴试剂B,所得沉淀y mol与试剂体积V(ml)间的关系.以下结论不正确的是( )
如图是向MgCl2、AlCl3混合溶液中,开始滴加6ml试剂A,之后改滴试剂B,所得沉淀y mol与试剂体积V(ml)间的关系.以下结论不正确的是( )| A. | A是盐酸,B是NaOH,且C(NaOH)=2C(HCl) | |
| B. | 原混合液中,C(Al3+):C(Mg2+):C(Cl-)=1:1:5 | |
| C. | A是NaOH,B是盐酸,且C(NaOH):C(HCl)=2:1 | |
| D. | 从6到9,相应离子反应式H++OH-═H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙炔分子比例模型: | B. | 乙烯分子的结构简式为CH2CH2 | ||
| C. | 一氯甲烷的电子式为: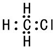 | D. | 2-甲基丁烷的键线式: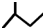 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 为测定熔融氢氧化钠的导电性,可将氢氧化钠固体放在石英坩埚中加热熔化 | |
| B. | 采取“静电除尘”、“燃煤固硫”、“汽车尾气催化净化”等方法,可提高空气质量 | |
| C. | 铝及其合金是电气、工业、家庭广泛使用的材料,通常用电解氯化铝的方法制取铝 | |
| D. | DNOP(邻苯二甲酸二辛酯)是一种由邻苯二甲酸和正辛醇经酯化反应而得的一种酯类有机化合物,常用作增塑剂、溶剂以及气相色谱固定液,对人体无害,可用作食品添加剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | t1时减小了A(g)的浓度,增加了C(g)的浓度,平衡向逆反应方向移动 | |
| B. | t1时升高了温度,平衡向逆反应方向移动 | |
| C. | t1时增加了A(g)和B(g)的浓度,平衡向正反应方向移动 | |
| D. | t1时减小了压强,平衡向逆反应方向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素的原子结构决定了元素在周期表中的位置 | |
| B. | 同一周期从左到右,元素的金属性逐渐增强、非金属性逐渐减弱 | |
| C. | 第IA元素全部是金属元素 | |
| D. | 可在过渡元素中寻找半导体材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X原子的电子层数比Y原子的电子层数多 | |
| B. | X的单质一定能将Y从NaY的水溶液中置换出来 | |
| C. | X的单质比Y的单质更容易与氢气反应 | |
| D. | X的氢化物水溶液的酸性一定比Y的氢化物水溶液的酸性强 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com