
| ʱ�䣨s�� | 0 | 20 | 40 | 60 | 80 |
| n ��NO2��/mol | 0.40 | n1 | 0.26 | n3 | n4 |
| n��N2O4��/mol | 0.00 | 0.05 | n2 | 0.08 | 0.08 |
| n(ת����) |
| n(��) |
| ||
| 20s |
| 0.08mol |
| 2L |
| 0.24mol |
| 2L |
| c(N 2O 4) |
| c(NO 2)2 |
| 0.04 |
| 0.12��0.12 |
| 0.16 |
| 0.4 |


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| ������Ʒ��ʣ������ |
| ������Ʒ����ʼ���� |
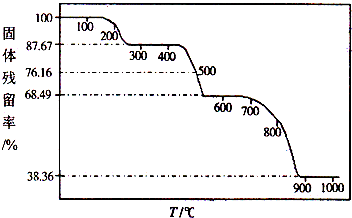
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
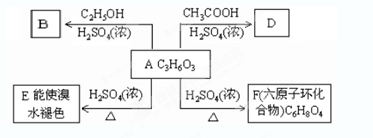
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 ��A��B��C��D��E��M��N������ת����ϵ��
��A��B��C��D��E��M��N������ת����ϵ��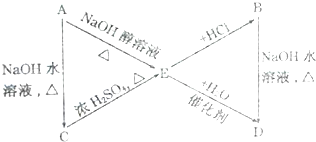
| O2 |
| ���Ƶ�Cu(OH)2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| ���� |
| �� |
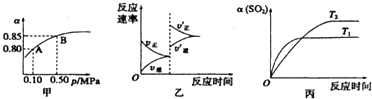
| A����ͼ��֪��A��SO2��ƽ��Ũ��Ϊ0.4 mol/L |
| B����SO2��O2��SO3��ƽ��Ũ��֮��Ϊ2��1��2 |
| C����ƽ�����С�����ݻ�����Ӧ���ʱ仯ͼ�������ͼ�ұ�ʾ |
| D��ѹǿΪ0.50 MPaʱ��ͬ�¶���SO2ת�������¶ȹ�ϵ���ͼ����T2��T1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| ���� | ϡ���ᣨml�� | ʣ����壨g�� |
| 1 | �ȼ���5.0 | 1.32 |
| 2 | ����5.0 | 0.64 |
| 3 | ����5.0 | 0.20 |
| 4 | ����5.0 | 0.20 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
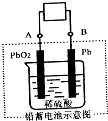 CuSO4��ҺΪ�������Һ���д�ͭ����Al��Zn��Ag��Pt��Au�����ʣ��ĵ�⾫��������˵����ȷ����
CuSO4��ҺΪ�������Һ���д�ͭ����Al��Zn��Ag��Pt��Au�����ʣ��ĵ�⾫��������˵����ȷ����2- 4 |
| �ŵ� |
| ��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
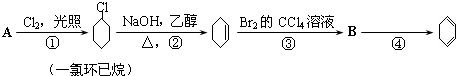
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A����������������Һ�ķ�Ӧ�����û���Ӧ |
| B��SO2��CO2�������������������NaOH��Һ��Ӧ |
| C��Na2O��Na2O2���Ԫ����ͬ����CO2��Ӧ����Ҳ��ȫ��ͬ |
| D��C��N��S���ֵ���ֱ����O2��Ӧ���������������������� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com