
【题目】某原电池装置如图所示,电池总反应为 2Ag + Cl2 = 2AgCl。已知阳离子交换膜只允许阳离子通过,阴离子不能通过,离子交换过程中溶液电荷守恒。下列说法正确的是
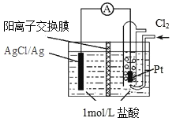
A.正极反应式为 AgCl + e—= Ag + Cl—
B.放电时,交换膜右侧溶液中有大量白色沉淀生成
C.若用 NaCl 溶液代替盐酸,则电池总反应随之改变
D.当外电路中转移 0.1mol e—时,阳离子交换膜左侧溶液中约减少0.2mol 离子
【答案】D
【解析】
依据电池总反应2Ag+Cl2=2AgCl可知,银元素的化合价升高发生氧化反应,氯气中的氯元素化合价降低发生还原反应,所以银是原电池负极,铂是原电池的正极,结合原电池原理分析解答。
A.正极上氯气得电子生成氯离子,电极反应式为:Cl2+2e—═2Cl—,故A错误;
B.放电时,在负极上有银离子生成,银离子在左侧和氯离子反应生成AgCl沉淀,交换膜左侧的氢离子向右侧移动,故B错误;
C.根据电池总反应2Ag+Cl2═2AgCl可知,用NaCl溶液代替盐酸,电池的总反应不变,故C错误;
D.放电时,当电路中转移0.1mol e—时,交换膜左侧会有0.1mol氢离子通过阳离子交换膜向右侧移动,同时会有0.1molAg失去0.1mol电子生成银离子,银离子会与氯离子反应生成氯化银沉淀,所以氯离子会减少0.1mol,则交换膜左侧溶液中共约减少0.2mol离子,故D正确;
故选D。


科目:高中化学 来源: 题型:
【题目】将24.0gNaOH固体溶于水配成100mL溶液,其密度为1.20g﹒mL-1。试计算:.
(1)该溶液中NaOH的物质的量浓度为______。
(2)该溶液中NaOH的质量分数为______。。
(3)从该溶液中取出10mL,其中含NaOH的质量为___。
(4)将取出的10mL溶液加水稀释到100mL,稀释后溶液中NaOH的物质的量浓度为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】无机物可根据其组成和性质进行分类。现有Cl2、Na、CO2、Na2O、Na2O2、NH3六种物质,完成下列填空:
(1)由分子构成的单质是____________,属于极性分子的是____________。
(2)既有离子键又有共价键的物质的电子式为____________。
(3)上述化合物中组成元素的原子半径由大到小的顺序是____________。
(4)根据与水反应的不同,上述物质可分成A组(CO2、Na2O和NH3)和B组(Cl2、Na和Na2O2),分组的依据是________________________。
(5)在酸性高锰酸钾溶液中加入Na2O2,溶液褪色,发生反应![]() (未配平),配平该反应的离子方程式并标出电子转移方向与数目。____________
(未配平),配平该反应的离子方程式并标出电子转移方向与数目。____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝广泛应用于航空、建筑、汽车等行业,目前工业上采用电解氧化铝和冰晶石(Na3AlF6)混合物的方法制取铝。回答下列问题:
(1)某同学写出了铝原子的4种不同状态的电子排布图
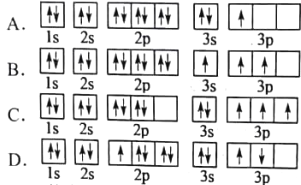
其中能量最低的是___________(填字母),电子由状态C到状态B所得原子光谱为___________光谱(填“发射”或“吸收”),状态D是铝的某种激发态,但该电子排布图有错误,主要是不符合____________________________________________。
(2)熔融状态的氯化铝可挥发出二聚分子Al2Cl6,其结构如图所示。
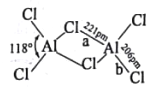
①a键的键能_________b键的键能(填“>”“<”或“=”),其理由是______________________。
②Al2Cl6中铝原子的杂化方式为___________;AlCl3的空间结构为 ___________________。
(3)冰晶石属于离子化合物,由Na+和AIF63-组成,在冰晶石的晶胞中,AlF63-占据的位置相当于氯化钠晶胞中Cl-的位置。
①冰晶石的化学式为___________,一个冰晶石晶胞中Na+的个数为___________。
②已知冰晶石的密度为2.95g/cm3,则冰品石晶胞的边长a=___________pm(列出算式即可,阿伏加德罗常数值为6.02×1023)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知三种有机物 ![]() (x)
(x) ![]() (y)
(y)![]() (z),下列说法不正确的是
(z),下列说法不正确的是
A.x、y、z 互为同分异构体,z 的二氯代物有三种
B.x、y 的一氯代物均只有三种,z 的一氯代物有一种
C.x、y 可使溴的四氯化碳溶液因发生加成反应而褪色
D.x、y、z 中只有 x 的所有原子可能处于同一平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)0.3 mol NH3分子中所含原子数与________个H2O分子中所含原子数相等。
(2)0.1 mol/L Al2(SO4)3溶液100mL与0.3mol/LK2SO4溶液200mL混合,则所得溶液中硫酸根离子的物质的量浓度为__________。(混合后,忽略体积变化)
(3)相同质量的SO2、SO3的氧原子的个数之比为____,体积比_______。
(4)液态化合物在一定量的氧气中恰好完全燃烧,反应方程式为:XY2(l)+3O2(g)=XO2(g)+2YO2(g)冷却后,在标准状况下测得生成物的体积是336mL,密度是2.56g/L.
①反应前O2的体积是_____mL(标准状况),化合物XY2的摩尔质量是_____.
②若XY2分子中X、Y两元素的质量比是3:16,则X、Y两元素分别为_____和_____(写元素符号).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】黄铜矿是工业炼铜的主要原料,其主要成分为CuFeS2,现有一种天然黄铜矿(含少量脉石),为了测定该黄铜矿的纯度,某同学设计了如下实验:
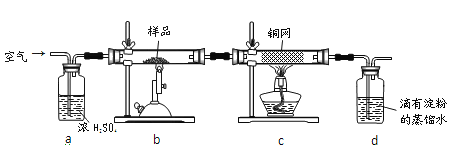
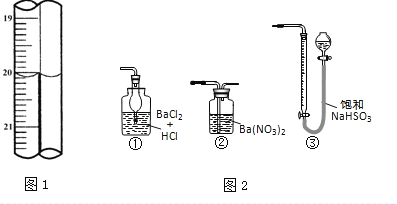
现称取研细的黄铜矿样品1.150g,在空气存在下进行煅烧,生成Cu、Fe3O4和SO2气体,实验后取d中溶液的1/10置于锥形瓶中,用0.05mol/L标准碘溶液进行滴定,初读数为0.00mL,末读数如图1所示。完成下列填空:
(1)称量样品所用的仪器为___,将样品研细后再反应,其目的是__________。
(2)装置a的作用是___________。上述反应结束后,仍需通一段时间的空气,其目的是___。
(3)滴定时,标准碘溶液所耗体积为___mL。判断滴定已达终点的现象是_____________。
(4)通过计算可知,该黄铜矿的纯度为_________。
(5)若用图2装置替代上述实验装置d,同样可以达到实验目的的是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图中 A、B、C、D 分别是三种烃的分子结构,请回答下列问题:
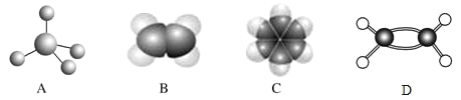
(1)上图中 D 是有机物分子的_____模型;
(2)烃 A 及其同系物的分子式符合通式_____(碳原子个数用 n 表示),当 n=6 时的同分异构体数目为_____(填数字)种;
(3)上述三种有机物烃中,所有原子均共平面的是_________(填有机物的名称);
(4)下列关于烃 C 的叙述正确的是_____(填序号)。
A.分子式为 C6H6,它不能使酸性 KMnO4 溶液褪色,属于饱和烃
B.从分子结构看,C 分子中含有碳碳双键,属于烯烃
C.烃 C 的同系物二甲苯(C8H10)有三种不同的结构,均属于芳香烃
D.烃 C 中加入溴水,充分振荡,静置,下层无色
(5)分别写出 B 使溴水褪色、C 的溴代反应的化学方程式____________、_____________,并指明反应类型:________________、______________
(6)C 的同系物甲苯与足量氢气加成后的产物(甲基环己烷)的一氯代物有_____种。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)现有34 g某气体,它们的摩尔质量为17 g·mol-1。则:
①该气体的物质的量为______mol。
②该气体所含分子数为______NA。
③该气体在标准状况下的体积为______L。
④该气体完全溶解于500 mL水后稀释到2 L,物质的量浓度为______mol·L-1。
(2)______g H2O中的氧原子数目与标准状况下22.4 L CO2 中的氧原子数目相同。
(3)摩尔质量是指单位物质的量的物质所具有的质量。
①已知NH3的相对分子质量为17,则NH3的摩尔质量为_____。
②NA 为阿伏加德罗常数,已知a g 某气体中含分子数为b,则该气体的摩尔质量为_____。
③已知一个铁原子的质量为b g,则铁原子摩尔质量为_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com