
| A. | N2O | B. | N2 | C. | NO | D. | NO2 |
分析 Mg和某浓度的硝酸反应,消耗二者的物质的量比为2:5时,设物质的量分别为2mol、5mol,结合原子守恒和电子守恒来计算.
解答 解:Mg和某浓度的硝酸反应,参加反应镁与消耗的硝酸的物质的量之比为2:5时,设物质的量分别为2mol、5mol,则生成2molMg(NO3)2,未被还原HNO3的物质的量为4mol,
设硝酸的还原产物中N元素的化合价为n,被还原的硝酸的物质的量为5mol-4mol=1mol,
由电子守恒可知,2mol×(2-0)=1mol×(5-n),解得n=+1,应生成N2O,
故选A.
点评 本题考查氧化还原反应的计算,为高频考点,把握反应中电子守恒和原子守恒的应用为解答的关键,侧重分析与计算能力的考查,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 构成单质分子的微粒中不一定含有化学键 | |
| B. | 只含有共价键的物质一定是共价化合物 | |
| C. | NaCl溶于水破坏了离子键,乙醇溶于水破坏了共价键 | |
| D. | CaCl2中既有共价键又有离子键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 手持试管给试管里的物质加热 | |
| B. | 用天平称量药品时,用手直接取放砝码 | |
| C. | 用pH试纸测定溶液的酸碱性时,一定要先把试纸用蒸馏水润湿一下 | |
| D. | 两端有大、小两匙的药匙,取用很少量的氧化铜粉末时应用小匙 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 族周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | A | |||||||
| 2 | D | E | G | |||||
| 3 | B | C | J | F | H | I |
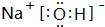 ;酸性最强的是HClO4,呈两性的是Al(OH)3;
;酸性最强的是HClO4,呈两性的是Al(OH)3;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素 | 相关信息 |
| X | 原子核内无中子 |
| Y | 组成蛋白质的基础元素,其最高正化合价与最低负化合价的代数和为2 |
| Z | 地壳中含量最高的元素 |
| W | 原子质量数为23,中子数为12 |
| R | 其离子是第三周期金属元素的离子中半径最小的 |
 ,X、Y、Z形成的化合物可用作化肥,该物质所含化学键的类型是离子、共价(填共价或离子);X与Z形成的18e-微粒的结构式为H-O-O-H.
,X、Y、Z形成的化合物可用作化肥,该物质所含化学键的类型是离子、共价(填共价或离子);X与Z形成的18e-微粒的结构式为H-O-O-H.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ba(OH)2•8H2O与NH4Cl反应 | B. | 灼热的C与CO2的反应 | ||
| C. | CH4与O2的燃烧反应 | D. | 铝与稀硫酸的反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:1:1 | B. | 1:2:7 | C. | 4:2:7 | D. | 2:4:7 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
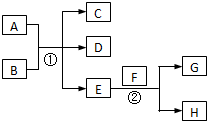 已知常温下E为无色无味的液体,F为淡黄色粉末,G为常见的无色气体(反应条件均已略去),请回答下列问题:
已知常温下E为无色无味的液体,F为淡黄色粉末,G为常见的无色气体(反应条件均已略去),请回答下列问题: .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com