
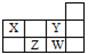
| A.X和Y元素的原子最外层电子数之和等于Z元素的原子最外层电子数的2倍 |
| B.Y元素的非金属性强于W元素的,其最高价氧化物水化物的酸性也强于W的 |
| C.X最简单氢化物溶于水呈碱性,Z最简单氢化物溶于水呈酸性 |
| D.W元素形成的单质可以从Z元素氢化物的水溶液中置换出Z单质 |
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:不详 题型:填空题
| A.最高价氧化物对应水化物的酸性 | B.H2O(g) 比NH3(g)稳定 |
| C.单质与H2反应的难易程度 | D.NO中氮元素显正价,氧元素显负价 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.①③ | B.②③ | C.①④ | D.②④ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
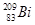 i和
i和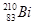 的说法正确的是
的说法正确的是A.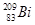 i和 i和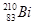 都含有83个中子 都含有83个中子 |
B.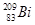 和 和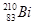 互为同位素 互为同位素 |
C.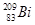 i和 i和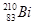 的核外电子数不同 的核外电子数不同 |
D.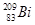 i和 i和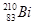 都含有83个质子,是同一种核素 都含有83个质子,是同一种核素 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.X的氢化物溶液与其最高价氧化物对应的水化物溶液的酸碱性相反 |
| B.Y的氧化物既可与强酸反应又可与强碱反应,并可用来制作耐火材料 |
| C.X和Z的最高价氧化物对应的水化物的浓溶液都是具有强氧化性的酸 |
| D.Z的氢化物比X的氢化物更稳定 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.①③ | B.②④ | C.①② | D.③⑤ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 元素 | 有关信息 |
| A | 最高价氧化物对应的水化物(甲)能与其气态氢化物(乙)反应生成盐 |
| B | 最外层电子数是次外层电子数的2倍 |
| C | M层上有3个电子 |
| D | 短周期原子半径最大的主族元素 |
| E | 其单质是淡黄色固体 |
| F | 最高正价与最低负价代数和为6 |
 ⑥ DF的电子式为H∶Cl∶
⑥ DF的电子式为H∶Cl∶查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com