
【题目】能源是国民经济发展的重要基础,我国目前使用的能源主要是化石燃料。
(1)已知: ![]()
![]()
![]()
则煤气化主要反应![]() ________________
________________
(2)已知![]() 的正反应速率为
的正反应速率为![]() ,逆反应速率为
,逆反应速率为![]() ,k为速率常数。2500K时,
,k为速率常数。2500K时, ![]() ,则该温度下的反应平衡常数K=_________________ 。
,则该温度下的反应平衡常数K=_________________ 。
(3)甲醇制甲醚的有关反应为: ![]() 一定温度下,在三个容积均为1.0 L的恒容密闭容器中发生该反应。
一定温度下,在三个容积均为1.0 L的恒容密闭容器中发生该反应。
容器编号 | 温度/℃ | 起始物质的量/mol | 平衡物质的量/mol | |
CH3OH | CH3OCH3 | H2O | ||
I | 387 | 0. 20 | x | |
II | 387 | 0. 40 | y | |
Ⅲ | 207 | 0. 20 | 0. 090 | 0. 090 |
![]() ________________.
________________.
②已知![]() 时该反应的化学平衡常数K=4。该温度下,若起始时向容器I中充入0.10mol
时该反应的化学平衡常数K=4。该温度下,若起始时向容器I中充入0.10mol ![]() ,则反应将向_________(填“正”或“逆”)反应方向进行。
,则反应将向_________(填“正”或“逆”)反应方向进行。
③容器Ⅱ中反应达到平衡后,若要进一步提高甲醚的产率,可以采取的措施为______________(填序号)
A.升高温度 B.其他条件不变,增加![]() 的物质的量
的物质的量
C.降低温度 D.保持其他条件不变,通入氖气
(4)为减少雾霾、降低大气中有害气体含量,研究机动车尾气中![]() 及
及![]() 的排放量意义重大。机动车尾气污染物的含量与空/燃比(空气与燃油气的体积比)的变化关系示意图如图所示:
的排放量意义重大。机动车尾气污染物的含量与空/燃比(空气与燃油气的体积比)的变化关系示意图如图所示:

①当空/燃比达到15后![]() 减少的原因可能是__________(填字母)。
减少的原因可能是__________(填字母)。
a.反应![]() 是吸热反应
是吸热反应
b.当空/燃比大干15后,燃油气燃烧放出的热量相应减少
②随空/燃比增大,CO和![]() 的含量减少的原因是______。
的含量减少的原因是______。
【答案】![]() 0.40 1/2 正 C ab 随空/燃比增大,燃油气燃烧更充分,故CO和
0.40 1/2 正 C ab 随空/燃比增大,燃油气燃烧更充分,故CO和![]() 的含量减少
的含量减少
【解析】
根据盖斯定律计算反应热;根据平衡常数表达式进行相关计算;根据化学平衡移动原理判断平衡的移动。
(1)根据盖斯定律得:![]() =
=![]() =
=![]() ;
;
(2)达到平衡时υ正=υ逆,根据平衡常数表达式及题干信息得:K= ;
;
(3)根据转化之比等于化学计量数之比,容器I达到平衡时H2O的物质的量为xmol;两容器内温度、容积相同,又因为该反应前后气体分子数保持不变,容器II中起始量为容器I的2倍,故容器I和容器II为比例等效平衡,则平衡时,生成的H2O的物质的量容器II也为容器I的2倍,所以![]() 1/2;
1/2;
②因为该反应前后气体分子数保持不变,Qc=![]() ,Qc<K,所以平衡正向移动;
,Qc<K,所以平衡正向移动;
③A.387℃时,平衡常数K=4,因为该反应前后气体分子数保持不变,K=![]() ,则x=0.08,207℃时,甲醚的物质的量为0.09mol,则根据化学平衡移动原理分析知该反应为放热反应;升高温度,平衡向逆反应方向移动,甲醚的产率降低,故A错误;
,则x=0.08,207℃时,甲醚的物质的量为0.09mol,则根据化学平衡移动原理分析知该反应为放热反应;升高温度,平衡向逆反应方向移动,甲醚的产率降低,故A错误;
B.其他条件不变,增加![]() 的物质的量,甲醚的产率不变,故B错误;
的物质的量,甲醚的产率不变,故B错误;
C.降低温度,平衡正向移动,甲醚产率提高,故C正确;
D.该反应前后气体分子数不变,所以通入氖气时,平衡不移动,甲醚的产率不变,故D错误,故答案为:C;
(4)①a.反应![]() 是吸热反应,增加空气的量,温度降低,平衡逆向移动,NOx含量降低,故a为可能原因;
是吸热反应,增加空气的量,温度降低,平衡逆向移动,NOx含量降低,故a为可能原因;
b.当空/燃比大干15后,燃油气燃烧放出的热量相应减少,平衡逆向移动,故b为可能原因;
②随空/燃比增大,燃油气燃烧更充分,故CO和![]() 的含量减少。
的含量减少。


科目:高中化学 来源: 题型:
【题目】甲烷在加热条件下可还原氧化铜,气体产物除水蒸气外,还有碳的氧化物。某化学小组利用如图装置探究其反应产物。

[查阅资料]①CO能与银氨溶液反应:CO+2[Ag(NH3)2]++2OH-===2Ag↓+2NH4++CO32-+2NH3。
②Cu2O为红色,不与Ag+反应,能发生反应:Cu2O+2H+===Cu2++Cu+H2O。
(1)装置A中反应的化学方程式为___________________________________________。
(2)按气流方向各装置从左到右的连接顺序为A→__________________。(填字母编号)
(3)实验中滴加稀盐酸的操作为______________________________________________。
(4)已知气体产物中含有CO,则装置C中可观察到的现象是________________;装置F的作用为_________________________________________。
(5)当反应结束后,装置D处试管中固体全部变为红色。
①设计实验证明红色固体中含有Cu2O:______________________________________________。
②欲证明红色固体中是否含有Cu,甲同学设计如下实验:向少量红色固体中加入适量0.1mol·L1AgNO3溶液,发现溶液变蓝,据此判断红色固体中含有Cu。乙同学认为该方案不合理,欲证明甲同学的结论,还需增加如下对比实验,完成表中内容。
实验步骤(不要求写出具体操作过程) | 预期现象和结论 |
__________________ | 若观察到溶液不变蓝,则证明红色固体中含有Cu;若观察到溶液变蓝,则不能证明红色固体中含有Cu |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)水的电离平衡曲线如右图所示,若A点表示25 ℃时水的电离达平衡时的离子浓度,B点表示100 ℃时水的电离达平衡时的离子浓度。则100 ℃时1 mol·L-1的NaOH溶液中,由水电离出的c(H+)=________mol·L-1,KW(25 ℃)________KW(100 ℃)(填“>”、“<”或“=”)。

(2)25 ℃时,向水的电离平衡体系中加入少量NH4Cl固体,对水的电离平衡的影响是________(填“促进”、“抑制”或“不影响”)。
已知如表数据。
化学式 | 电离平衡常数(25 ℃) |
HCN | K=4.9×10-10 |
CH3COOH | K=1.8×10-5 |
H2CO3 | K1=4.3×10-7 K2=5.6×10-11 |
(3)25 ℃时,有等浓度的NaCN溶液、Na2CO3溶液、CH3COONa溶液,三种溶液的pH由大到小的顺序为____ ___。(填化学式)
(4)25 ℃时,等浓度的CH3COOH溶液和NaOH溶液等体积混合,所得溶液显碱性,则c(Na+)________c(CH3COO-)(填“>”、“<”或“=”)。
(5)向NaCN溶液中通入少量CO2,反应的化学方程式为________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列说法正确的是
A. 常温下,pH =1的盐酸中含有H+的数目为0.1NA
B. 标准状况下,22.4 LCl2与Fe完全反应时,转移电子数为3NA
C. 32gO2和32gO3中所含原子数均为2NA
D. 常温常压下,28 g乙烯含有2NA个碳碳双键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】霉酚酸酯(MMF)是器官移植中抑制细胞增殖最常用的药物,它在酸性溶液中能发生如下反应:

下列说法中正确的是
A. 1molMMF与足量NaOH 溶液共热,最多可消耗5molNaOH
B. 可以用NaHCO3溶液区别MMF与化合物Ⅰ
C. 化合物 R的分子式为C6H13NO2
D. 一个MMF分子中含有2个手性碳原子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】胡椒醛衍生物在香料、农药、医药等领域有着广泛用途,A为香草醛,以A为原料合成5-三氟甲基胡椒醛(E)的路线如图所示:

已知:
(1)反应①的类型是 。
(2)写出A中含氧官能团的名称 。
(3)写出反应③的化学方程式 。
(4)写出满足下列条件A的一种同分异构体的结构简式 。
①能与碳酸氢钠溶液反应放出气体
②不与氯化铁溶液发生显色反应
③含苯环,核磁共振氢谱显示其有5种不同化学环境的氢原子
(5)以A和2-氯丙烷为原料,可合成香草醛缩丙二醇( ),写出合成流程图(无机试剂任用)。合成流程图示例如下:
),写出合成流程图(无机试剂任用)。合成流程图示例如下:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物A只含有C、H、O三种元素,常用作有机合成的中间体。16.8 g该有机物经燃烧生成44.0 g CO2和14.4 g H2O;质谱图表明其相对分子质量为84,红外光谱分析表明A分子中含有O-H键和-C≡C-H,核磁共振氢谱上有三个峰,峰面积之比为6∶1∶1。
(1)A的分子式是 。
(2)下列物质中,一定条件下能与A发生反应的是 。
a.H2 b.Na c.酸性KMnO4溶液 d.Br2
(3)A的结构简式是 。
(4)有机物B是A的同分异构体,能发生银镜反应,1 mol B最多能与2 mol H2加成。B中所有碳原子一定处于同一个平面,请写出所有符合条件的B的结构简式(不考虑立体异构) 、 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W、Q、X、Y、Z为短周期元素且原子序数依次增大,X原子的K层电子数与M层电子数相等,Y是常用的灰黑色半导体材料,通常状态下YW4呈气态。下图是晶体Y的一种制备路线图。有关说法正确的是
![]()
A. 标准状况下,WZ为液态B. 原子半径大小为W<X<Y
C. YQ2和YW4均只含极性共价键D. 氢化物的稳定性为Q>Y>Z
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,用相同浓度的NaOH溶液,分别滴定浓度均为0.1mol·L-1的三种酸(HA、HB和HD)溶液,滴定的曲线如图所示,下列判断错误的是( )
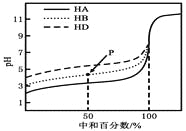
A. 三种酸的电离常数关系:KHA>KHB>KHD
B. 滴定至P点时,溶液中:c(B-)>c(Na+)>c(HB)>c(H+)>c(OH-)
C. pH=7时,三种溶液中:c(A-)=c(B-)=c(D-)
D. 当中和百分数达100%时,将三种溶液混合后:c(HA)+c(HB)+c(HD)=c(OH-)-c(H+)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com