
常温下30 mL的乙烯和乙炔的混合气体在100 mL O2中完全燃烧,冷却到原来温度时,气体体积是75 mL,则混合气体中乙烯和乙炔的体积比是( )
A.1∶2 B.2∶1 C.1∶4 D.任意比
科目:高中化学 来源: 题型:阅读理解
| 实 验 混合溶液 |
A | B | C | D | E | F |
| 4mol?L-1H2SO4/mL | 30 | V1 | V2 | V3 | V4 | V5 |
| 饱和CuSO4溶液/mL | 0 | 0.5 | 2.5 | 5 | V6 | 20 |
| H2O/mL | V7 | V8 | V9 | 15 | 10 | 0 |
| 组别 | c(HA)/mol?L-1 | c(NaOH)/mol?L-1 | 混合液pH |
| 甲 | c | 0.2 | pH=7 |
| 乙 | 0.2 | 0.1 | pH>7 |
| 丙 | 0.1 | 0.1 | pH=9 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
为探究铜与浓硫酸的反应,某兴趣小组进行了如下实验。
【实验1】铜与浓硫酸反应,实验装置如图所示。
(1)、装置A中发生反应的化学方程式为:
(2)、熄灭酒精灯后,因为有导管存在,B中的液体不会倒吸,其原因是: 。
拆除装置前,不打开胶塞,为了使装置中的残留气体完全被吸收,应当采取的操作是: 。
【实验2】实验中发现试管内除了产生白色固体外,在铜丝表面还有黑色固体甲生成,甲中可能含有氧化铜、氧化亚铜、硫化铜、硫化亚铜。
查阅资料:
①氧化亚铜在酸性环境下会发生自身氧化还原反应生成Cu2+和铜单质,在空气中充分煅烧,可以转化为氧化铜。
②硫化铜和硫化亚铜常温下都不溶于稀盐酸,在空气中充分煅烧,均转化为氧化铜和二氧化硫。
为了研究甲的成分,该小组同学在收集到足够量的固体甲后,进行了如下实验:
(3)、步骤②中检验滤渣是否洗涤干净的实验方法是: 。
(4)、固体乙在空气中煅烧时,使用的实验仪器除了玻璃棒、三脚架、酒精灯外,还必须有:
。
(5)、确定乙是否煅烧完全的操作是: 。
(6)、煅烧过程中一定发生的化学反应方程式为: 。
高氯酸铵(NH4ClO4)是复合火箭推进剂的重要成分,实验室可通过下列反应制取:
NaClO4(aq)+NH4Cl(aq) NH4ClO4(aq)+NaCl(aq)
(7)、用氨气和浓盐酸代替NH4Cl,上述反应不需要外界供热就能进行,其原因是:
。
(8)、反应得到的混合溶液中NH4ClO4和NaCl的质量分数分别为0.30和0.l5(相关物质的溶解度曲线如下图)。从混合溶液中获得较多NH4ClO4晶体的实验操作依次为(填操作名称)蒸发浓缩, ,过滤, 、干燥。
为了测定样品中NH4ClO4的含量,装置如上图所示(加热装置、仪器固定装置已略去),实验步骤如下:

(9)、步骤3中,准确取用24.00 mL H2SO4(aq)的玻璃仪器是 。
(10)、实验中确保生成的氨被稀硫酸完全吸收的实验步骤是 (填写步骤编号)。
(11)、必须重复实验2~3次,其原因是 。
(12)、如果0.320 g试样中含NH4ClO4的准确值为0.095g,而实验测定结果是0.092g 。该实验
的相对误差为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
(14分)Ⅰ.在用稀硫酸与锌制取氢气的实验中,加入少量硫酸铜溶液可加快氢气的生成速率。请回答下列问题:
(1)加入少量硫酸铜溶液可以加快氢气生成速率的原因是 ;
(2)要加快上述实验中气体产生的速率,还可采取的措施有 (答两种);
(3)为了进一步研究硫酸铜的量对氢气生成速率的影响,某学习小组设计了如下一系列实验。将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需时间。
| 实 验 混合溶液 | A | B | C | D | E | F |
| 4 mol·L-1H2SO4 / mL | 30 | V1 | V2 | V3 | V4 | V5 |
| 饱和CuSO4溶液 / mL | 0 | 0.5 | 2.5 | 5 | V6 | 20 |
| H2O / mL | V7 | V8 | V9 | 15 | 10 | 0 |
请完成此实验设计,其中:V2 V5 = , V6= ,V8= ;
(第一空填“>”、“<”或“=”;后三空填具体数值)
Ⅱ.常温下,某一元酸HA和NaOH溶液等体积混合,HA和NaOH的浓度以及混合后溶液的pH如下表:
| 组别 | c(HA)/mo1·L-1 | c(NaOH)/mo1·L-1 | 混合液pH |
| 甲 | c | 0.2 | pH = 7 |
| 乙 | 0.2 | 0.1 | pH>7 |
| 丙 | 0.1 | 0.1 | pH = 9 |
请回答下列问题:
(4)仅从甲组情况分析,c是否一定等于0.2 ? (选填“是”或“否”)。
(5)分析乙组实验数据,HA是 酸(选填“强”或“弱”)。该混合液中离子浓度由大到小的顺序是 。
(6)丙组所得混合液中由水电离出的c(OH-) = mo1·L-1。
查看答案和解析>>
科目:高中化学 来源:2012届上海市普陀区高三上学期期末质量抽测化学试卷 题型:实验题
为探究铜与浓硫酸的反应,某兴趣小组进行了如下实验。
【实验1】铜与浓硫酸反应,实验装置如图所示。
(1)、装置A中发生反应的化学方程式为:
(2)、熄灭酒精灯后,因为有导管存在,B中的液体不会倒吸,其原因是: 。
拆除装置前,不打开胶塞,为了使装置中的残留气体完全被吸收,应当采取的操作是: 。
【实验2】实验中发现试管内除了产生白色固体外,在铜丝表面还有黑色固体甲生成,甲中可能含有氧化铜、氧化亚铜、硫化铜、硫化亚铜。
查阅资料:
①氧化亚铜在酸性环境下会发生自身氧化还原反应生成Cu2+和铜单质,在空气中充分煅烧,可以转化为氧化铜。
②硫化铜和硫化亚铜常温下都不溶于稀盐酸,在空气中充分煅烧,均转化为氧化铜和二氧化硫。
为了研究甲的成分,该小组同学在收集到足够量的固体甲后,进行了如下实验:
(3)、步骤②中检验滤渣是否洗涤干净的实验方法是: 。
(4)、固体乙在空气中煅烧时,使用的实验仪器除了玻璃棒、三脚架、酒精灯外,还必须有:
。
(5)、确定乙是否煅烧完全的操作是: 。
(6)、煅烧过程中一定发生的化学反应方程式为: 。
高氯酸铵(NH4ClO4)是复合火箭推进剂的重要成分,实验室可通过下列反应制取:
NaClO4(aq)+NH4Cl(aq) NH4ClO4(aq)+NaCl(aq)
NH4ClO4(aq)+NaCl(aq)
(7)、用氨气和浓盐酸代替NH4Cl,上述反应不需要外界供热就能进行,其原因是:
。
(8)、反应得到的混合溶液中NH4ClO4和NaCl的质量分数分别为0.30和0.l5(相关物质的溶解度曲线如下图)。从混合溶液中获得较多NH4ClO4晶体的实验操作依次为(填操作名称)蒸发浓缩, ,过滤, 、干燥。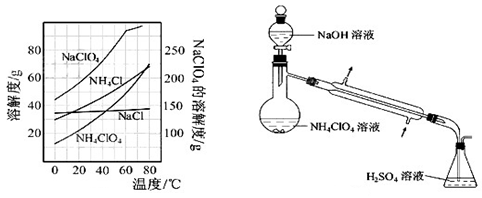
为了测定样品中NH4ClO4的含量,装置如上图所示(加热装置、仪器固定装置已略去),实验步骤如下:
(9)、步骤3中,准确取用24.00 mL H2SO4(aq)的玻璃仪器是 。
(10)、实验中确保生成的氨被稀硫酸完全吸收的实验步骤是 (填写步骤编号)。
(11)、必须重复实验2~3次,其原因是 。
(12)、如果0.320 g试样中含NH4ClO4的准确值为0.095g,而实验测定结果是0.092g。该实验
的相对误差为 。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年上海市高三上学期期中考试化学试卷(解析版) 题型:填空题
如下图所示,将甲、乙两个装有不同物质的针筒用导管连接起来,将乙针筒内的物质缓缓地压到甲针筒内,进行下表所列的不同实验(气体体积在常温常压下测定)。

|
实验序号 |
甲针筒内物质 |
乙针筒内物质 |
甲针筒的现象 |
|
1 |
40 mL HCl |
40 mL NH3 |
产生白烟 |
|
2 |
40 mL Cl2 |
10mL 水 |
剩余气体为20mL |
|
3 |
30 mL NO |
15 mL O2 |
|
|
4 |
20 mL AlCl3溶液 |
10 mL NaOH溶液 |
生成白色沉淀,后消失 |
(1)如果实验1甲针筒内改装30 mL Cl2 ,乙针筒内仍为40 mL NH3,实验时,甲针筒内也有白烟产生。写出有关反应的化学方程式 。
(2)由实验2可知,常温常压下氯气在水中的溶解度为 。
(3)实验3 反应后甲针筒内气体的体积为 。
(4)实验4中,AlCl3溶液浓度为0.1mol/L,如果最后白色沉淀全部消失,则NaOH溶液浓度至少为 mol/L。
(5)将上述装置做以下改进:在甲、乙针筒之间连接一段硬质玻璃管,如下图。在A处装一种浅黄色的粉末,乙针筒内是一种常见的气体,甲针筒无气体。将乙针筒内气体压入甲针筒内,发现气体体积是原来的一半。A处的物质是 ,甲针筒内的气体为 。

(6)有学生用上述改进后的装置测定空气中氧气的体积分数(加热用酒精灯未画出)。乙针筒内装有50 mL空气。实验时,用酒精灯对A处物质进行加热,经反复慢慢推拉两针筒的活塞,反应完毕,恢复至室温,测得剩余气体为40.5mL。
①A处的物质是 (选填编号)。
a.碳粉 b.二氧化锰 c.铜粉 d.氧化铜
②已知空气中氧气的体积分数为0.2,则该实验的相对误差为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com