
【题目】下列说法正确的是
A. 等体积等物质的量浓度的CH3COONa(aq)与NaCl(aq)中离子总数大小:N前=N后
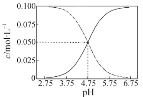
B. 常温下醋酸和醋酸钠混合溶液中c (CH3COOH)、c (CH3COO-)与pH值的关系如图所示,当pH=4.5溶液中:c (CH3COO-)> c (CH3COOH)> c (H+)> c (OH-)
C. 物质的量浓度相等的CH3COOH和CH3COONa溶液等体积混合后的溶液中:2 c(Na+)=c(CH3COO-)+ c(CH3COOH)
D. pH相等的盐酸与醋酸溶液,c(Cl-)>c(CH3COO-)
【答案】C
【解析】
A.醋酸是弱酸,所以CH3COONa溶液中发生水解反应: CH3COO-+H2OCH3COOH+OH-,使溶液呈碱性,氢离子浓度小于氢氧根离子浓度,所以NaCl溶液中c(Na+)+c(H+)大于CH3COONa溶液中c(Na+)+c(H+),根据电荷守恒: c(Na+)+c(H+)=c(OH-)+c(Cl-)可得溶液中离子总数为2![]() [c(Na+)+c(H+)]
[c(Na+)+c(H+)]![]() V;同理可得CH3COONa溶液中总数为2
V;同理可得CH3COONa溶液中总数为2![]() [c(Na+)+c(H+)]
[c(Na+)+c(H+)]![]() V,所以NaCl溶液中离子总数大于CH3COONa溶液,即N前<N后,故A错误;B.由图象可看出,浓度增大的曲线应为c(CH3COO-),浓度减小的曲线应为c(CH3COOH),W点pH=4.75时c(CH3COO-)= c(CH3COOH),所以当pH=4.5时,溶液中: c(CH3COOH)>(CH3COO-)>c(H+)>c(OH-),故B错误;C.物质的量浓度相等的CH3COOH和CH3COONa溶液等体积混合后的溶液中:根据物料守恒:2c(Na+)=c(CH3COO-)+ c(CH3COOH),故C正确;D. pH相等的盐酸与醋酸溶液,根据电荷守恒盐酸溶液中:c(Cl-)+ c(OH-)= c(H+);醋酸溶液中:c(CH3COO-)+c(OH-)=c(H+),因为pH相等,所以c(Cl-)= c(CH3COO-),故D错误;答案:C。
V,所以NaCl溶液中离子总数大于CH3COONa溶液,即N前<N后,故A错误;B.由图象可看出,浓度增大的曲线应为c(CH3COO-),浓度减小的曲线应为c(CH3COOH),W点pH=4.75时c(CH3COO-)= c(CH3COOH),所以当pH=4.5时,溶液中: c(CH3COOH)>(CH3COO-)>c(H+)>c(OH-),故B错误;C.物质的量浓度相等的CH3COOH和CH3COONa溶液等体积混合后的溶液中:根据物料守恒:2c(Na+)=c(CH3COO-)+ c(CH3COOH),故C正确;D. pH相等的盐酸与醋酸溶液,根据电荷守恒盐酸溶液中:c(Cl-)+ c(OH-)= c(H+);醋酸溶液中:c(CH3COO-)+c(OH-)=c(H+),因为pH相等,所以c(Cl-)= c(CH3COO-),故D错误;答案:C。


科目:高中化学 来源: 题型:
【题目】A、B、C、E、F是三个不同短周期的五种主族元素,其原子序数依次增大。A和E最外层电子数相同,1mol单质E跟足量酸完全反应时,产生标准状况下11.2L氢气;C2-与E+具有相同的电子层结构;B、C和F在周期表中相邻,B、C同周期,C、F同主族;请回答下列问题:
(1)写出E元素在周期表中的位置:______
(2)画出F原子的结构示意图:______
(3)用电子式表示化合物E2C的形成过程:______
(4)写出金属铜与元素F的最高价氧化物的水化物的浓溶液在加热条件下反应的化学方程式______
(5)A、B两种元素形成的离子型化合物的化学式为:______
(6)P和Q两种物质都是由A、C、E、F四种元素组成的酸式盐,等物质的量的P和Q恰好完全反应,写出该反应的离子方程式:______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】不同条件下,用O2氧化一定浓度的FeCl2溶液过程中所测的实验数据如图所示。下列分析或推测不合理的是
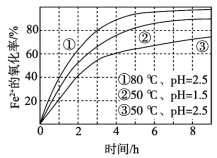
A. Fe2+的氧化率随时间延长而逐渐增大
B. 由②和③可知,pH越大,Fe2+氧化速率越快
C. 由①和③可知,温度越高,Fe2+氧化速率越快
D. 氧化过程的离子方程式为:4Fe2+ + O2 + 4H+ == 4Fe3+ + 2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)某学生为了探究锌与盐酸反应过程中的速率变化,在200mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如下(累计值):
时间(min) | 1 | 2 | 3 | 4 | 5 |
氢气体积(mL)(标准状况) | 50 | 120 | 232 | 290 | 310 |
①上述实验过程中,反应速率最大时间段是________(选填字母作答),该时间段反应速率最大的主要原因是________________________________________________________。
A.0~1min B.1~2min C.2~3min D.3~4min E.4~5min
②求2~3分钟时间段以盐酸的浓度变化来表示的该反应速率___________________(假设反应过程中溶液体积不变)。
(2)某温度下在容积为1L密闭容器中,X、Y、Z三种气态物质的物质的量随时间变化曲线如图。

①该反应的化学方程式是______________________________________________。
②该反应达到平衡状态的标志是________。
A.X的浓度不再改变
B.Y的体积分数在混合气体中保持不变
C.容器内气体的总压强保持不变
D.容器内气体的总质量保持不变
③反应进行到2min时,Y的转化率为_____________。
(3)燃料电池可以将气体燃料和氧气直接反应产生电能,其效率高、污染低,是一种很有前途的能源利用方式。但传统燃料电池使用氢气为燃料,而氢气既不易制取又难以储存,导致燃料电池成本居高不下。科研人员尝试用便宜的甲烷、乙烷等碳氢化合物为燃料,设计出新型燃料电池,使其成本大大低于以氢气为燃料的传统燃料电池。请写出以甲烷为燃料、硫酸为电解质溶液的该新型燃料电池工作时负极的电极反应方程式_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是
A. 用氨水吸收过量二氧化硫: NH3·H2O + SO2 = NH4++ HSO3-
B. 实验室用MnO2与浓盐酸加热反应制Cl2:MnO2+4HCl(浓)![]() Mn2++2Cl-+Cl2↑+2H2O
Mn2++2Cl-+Cl2↑+2H2O
C. 硫酸溶液与氢氧化钡溶液混合:Ba2++SO42-=BaSO4↓
D. 硫酸酸化的FeSO4 溶液中加入 H2O2溶液: Fe2++2H ++ H2O2= Fe3++2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2的捕捉、封存与再利用是实现温室气体减排的重要途径之一。请回答:
(1)二氧化碳的电子式为__________。
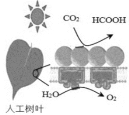
(2)一种正在开发的利用二氧化碳制取甲酸(HCOOH)的途径如图所示,图中能量主要转化方式为_____________ ,CO2和H2O转化为甲酸的化学方程式为____________。
(3)目前工业上有一种方法是用CO2生产燃料甲醇。一定条件下发生反应:CO2(g)+3H2(g)CH3OH(g)+H2O(g)。
①恒容容器中,能加快该反应速率的是_______。
a.升高温度 b.从体系中分离出CH3OH c.加入高效催化剂 d.降低压强
②在体积为2L的密闭容器中,充入1molCO2和3molH2,测得CO2的物质的量随时间变化如图所示。从反应开始到5min末,用H2浓度变化表示的平均反应速率________________。
t/min | 0 | 2 | 5 | 10 | 15 |
n(CO2)/mol | 1 | 0.75 | 0.5 | 0.25 | 0.25 |
③在相同温度、恒容的条件下,能说明该反应已达平衡状态的是_______(填序号)。
a.CO2、H2、CH3OH、H2O的浓度均不再改变化
b.n(CO2):n(H2):n(CH3OH):n(H2O)=1:1:1:1
c.容器中混合气体的密度不变
d.v消耗(H2)=3v消耗(CH3OH)
e.体系压强不变
(4)下列一些共价键的键能如下表所示:
化学键 | H-H | H-O | C=O | C-H | C-O |
键能kJ/mol | 436 | 463 | 803 | 414 | 326 |
反应CO2(g)+3H2(g)CH3OH(g)+H2O(g),______(填“吸收”或“放出”) 的热量为_____kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用无水乙酸钠和碱石灰混合制甲烷:CH3COONa+NaOH![]() CH4↑+Na2CO3,为了探究甲烷的化学性质,进行了以下实验,B装置中的试剂为溴水或酸性KMnO4溶液,一段时间后,无水硫酸铜变蓝,澄清石灰水变浑浊。所需装置如图(部分夹持仪器已略去):
CH4↑+Na2CO3,为了探究甲烷的化学性质,进行了以下实验,B装置中的试剂为溴水或酸性KMnO4溶液,一段时间后,无水硫酸铜变蓝,澄清石灰水变浑浊。所需装置如图(部分夹持仪器已略去):

(1)写出H装置中反应的离子方程式:______________________。
(2)C装置中的试剂为___________。
(3)实验测得消耗的CH4和CuO的质量比为1∶20,则D中硬质玻璃管内发生反应的化学方程式为______
(4)实验开始前,先在G装置的大试管上套上黑色纸套,反应结束后,取下黑色纸套,使收集满气体的试管置于光亮处缓慢反应一段时间,观察到的现象有:
①试管中有少量白雾;
②导管内液面上升
③_______
④_______
(5)有关该实验的说法,正确的是______(填字母)。
A.若B装置中的试剂是溴水,溴水无明显变化,说明CH4不能与卤素单质反应
B.若B中是酸性高锰酸钾溶液,溶液无明显变化,说明通常情况下甲烷难以被强氧化剂氧化
C.硬质玻璃管中的黑色固体粉末变红,说明甲烷具有氧化性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】回答下列问题:
(1)将等质量的镁分别与足量的CO2、O2、N2、空气中充分燃烧,反应前后固体增重由大到小的顺序为___。
(2)在常温下,实验室用固体亚硫酸钠和中等浓度的硫酸制取SO2气体。将制得的SO2气体通入紫色石蕊试液,可观察到的现象为___。
(3)在常温下,把NO气体压缩到1.01×108Pa,在一个体积固定的容器里加热到50℃,发现气体的压力迅速下降,压力降至略小于原压力![]() 就不再改变,已知其中一种产物为N2O,写出上述变化的化学方程式___。
就不再改变,已知其中一种产物为N2O,写出上述变化的化学方程式___。
(4)按如图进行实验,试管中装有NO,然后缓慢地通入84mLO2,充分反应后液面高度不变,则原试管中装有NO的体积为___。
(5)标况下,将一定体积的盛满NO、NO2、O2的混合气体的试管倒立于水槽中,水充满整个试管,则试管内的溶液的物质的量浓度范围是(假定试管内溶液不扩散)为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】优化反应条件是研究化学反应的重要方向。
(1)以硫代硫酸钠与硫酸的反应Na2S2O3 + H2SO4= Na2SO4 + SO2+ S↓ + H2O为例,探究外界条件对化学反应速率的影响,实验方案如下表所示。
实验 序号 | Na2S2O3溶液 | H2SO4溶液 | 蒸馏水 | 温度/℃ | ||
浓度/(mol/L) | 体积/mL | 浓度/(mol/L) | 体积/mL | 体积/mL | ||
I | 0.1 | 1.5 | 0.1 | 1.5 | 10 | 20 |
II | 0.1 | 2.5 | 0.1 | 1.5 | 9 | a |
III | 0.1 | b | 0.1 | 1.5 | 9 | 30 |
①表中,a为________________________,b为________________。
②实验表明,实验III的反应速率最快,支持这一结论的实验现象为_________________________。
(2)硫代硫酸钠可用于从含氧化银的矿渣中浸出银,反应如下:Ag2O + 4S2O32- + H2O ![]() 2[Ag(S2O3)2]3- + 2OH-,实际生产中,为了提高银的浸出率需要调节pH的范围为8.5~9.5,解释其原因________
2[Ag(S2O3)2]3- + 2OH-,实际生产中,为了提高银的浸出率需要调节pH的范围为8.5~9.5,解释其原因________
(3)工业上常用空气催化氧化法除去电石渣浆(含CaO)上清液中的S2-,并制取石膏(CaSO4·2H2O),其中的物质转化过程如下图所示。
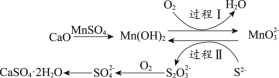
①过程I、II中,起催化剂作用的物质是_______________。
②过程II中,反应的离子方程式为_________。
③根据物质转化过程,若将10 L上清液中的S2-转化为SO42-(S2-浓度为320 mg/L),理论上共需要标准状况下的O2的体积为___________L。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com