
| 元素 | 有关信息 |
| X | 在自然界中原子半径最小 |
| Y | 最外层电子数是次外层的2倍 |
| Z | 元素的主要化合价为-2价 |
| M | 其单质及其化合物的焰色为黄色 |
| N | 与Y同主族,其单质为半导体材料 |
 ;Na2O中含有离子键,
;Na2O中含有离子键, ;离子键;
;离子键;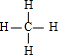 ;分子里各原子的空间分布具有正四面体结构;在光照的条件下,将1molYX4与1molCl2混合充分反应后,得到的产物有一氯甲烷、二氯甲烷、三氯甲烷、四氯甲烷、氯化氢,共有5种,
;分子里各原子的空间分布具有正四面体结构;在光照的条件下,将1molYX4与1molCl2混合充分反应后,得到的产物有一氯甲烷、二氯甲烷、三氯甲烷、四氯甲烷、氯化氢,共有5种,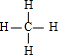 ;正四面体;5;
;正四面体;5;| 一定条件 |
 +3H2
+3H2| Ni |
| △ |
 ,
,| 一定条件 |
 +3H2
+3H2| Ni |
| △ |
 .
.

科目:高中化学 来源:不详 题型:单选题
| A.气态氢化物的稳定性:Y>Z |
| B.原子半径:X>Z>Y |
| C.X的最高价氧化物对应的水化物呈碱性 |
| D.X2O、YO2两种氧化物含有的化学键类型相同 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
| A | C | |
| B |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.③⑥ | B.①③ | C.③④⑤ | D.②⑥ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com