
【题目】在含Fe3+的S2O82-和I-的混合溶液中,反应S2O82-(aq)+2I-(aq)=2SO42-(aq)+I2(aq)的分解机理及反应进程中的能量变化如图:
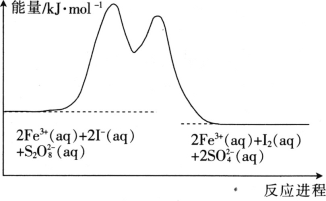
步骤①:2Fe3+(aq)+2I-(aq)=I2(aq)+2Fe2+(aq)
步骤②:2Fe2+(aq)+S2O82-(aq)=2Fe3+(aq)+2SO42-(aq)
下列有关该反应的说法正确的是
A. 反应速率与Fe3+浓度有关
B. Fe2+是该反应的催化剂
C. v(S2O82-)=v(I-)=v(I2)
D. 若不加Fe3+,则正反应的活化能比逆反应的大
【答案】A
【解析】
A.由反应S2O82-(aq)+2I-(aq)=2SO42-(aq)+I2(aq)分步进行为:步骤①:2Fe3+(aq)+2I-(aq)=I2(aq)+2Fe2+(aq),步骤②:2Fe2+(aq)+S2O82-(aq)=2Fe3+(aq)+2SO42-(aq),由此说明Fe3+为反应的催化剂,所以反应速率与Fe3+浓度有关,故A正确;
B.根据反应S2O82-(aq)+2I-(aq)=2SO42-(aq)+I2(aq)分步进行为:步骤①:2Fe3+(aq)+2I-(aq)=I2(aq)+2Fe2+(aq),步骤②:2Fe2+(aq)+S2O82-(aq)=2Fe3+(aq)+2SO42-(aq),由此说明Fe3+为反应的催化剂,故B错误;
C. 由反应S2O82-(aq)+2I-(aq)=2SO42-(aq)+I2(aq)可知:由反应S2O82-~2I-(aq)~I2,则2v(S2O82-)=v(I-)=2v(I2),故C错误;
D. 由图像可知该反应是个放热反应,加催化剂可以同时改变正逆反应的活化能,所以
若不加Fe3+,则正反应的活化能比逆反应的小,故D错误;
所以本题答案:A。


科目:高中化学 来源: 题型:
【题目】25℃时,Ka(CH3COOH)=1.7×10-5。该温度下,用0.1mol/L的醋酸溶液滴定10.00mL 0.1mol/L的MOH溶液,滴定过程中加入醋酸溶液的体积(V)与溶液中lg[c(H+)/c(OH-)]的关系如图所示(V=0时,lg[c(H+)c(OH-)]=-12)。下列说法不正确的是
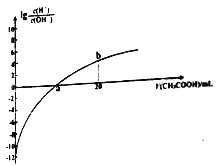
A. MOH是一元强碱
B. a 点:V(CH3COOH)=10.00mL
C. b R:c(M+)>(CH3COOH)>C(H+)>c(OH-)
D. 25℃时,CH3COO-的水解平衡常数约为5.9×10-10
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“绿水青山就是金山银山”,研究NO2、NO、CO、NO2-,碳氢化合物大气污染物和水污染物热处理对建设美丽中国具有重要意义。
(1)己知:汽车尾气中的CO、NOx、碳氮化合物是大气污染物。使用稀土等催化剂能将CO、NO转化成无毒物质。
已知:N2(g)+O2(g)=2NO(g) △H1=+180.5kJ/mol K1(该反应的平衡常数)
2C(s)+O2(g)=2CO(g) △H2=-221kJ/mol K2(同上)
C(s)+O2(g)=CO2(g) △H3=-393.5kJ/mol K3(同上)
写出NO(g)与CO(g)催化转化成N2(g)和CO2(g)的热化学方程式________,以及该热化学方程式的平衡常数K=________(用K1、K2、K3表示)
(2)污染性气体NO2与CO在一定条件下的反应为:2NO2+4CO![]() 4CO2+N2 △H=-1200kJ/mol。
4CO2+N2 △H=-1200kJ/mol。
①某温度下,在2L密闭容器中充入0.lmolNO2和0.2molCO,此时容器的压强为1个大气压,5秒时反应达到平衡时,容器的压强变为原来的29/30,则反应开始到平衡时NO2的平均反应速率v(NO2=_____mol/(L·s)。
②能使该反应的反应速率增大,且平衡向逆反应方向移动的是_______。
A.及时分离出CO2
B.适当升高温度
C.减小容器体积使体系压强增大
D.选择高效催化剂
(3)在高效催化剂作用下可用NH3还原NO2进行污染物处理。
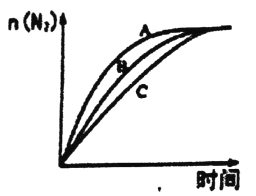
①相同条件下,选用A、B、C三种催化剂进行反应,生成氮气的物质的量与时间变化如图。活化能最小的是________。
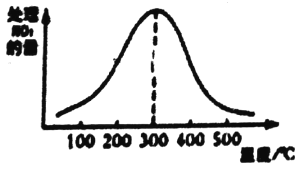
②在催化剂A作用下测得相同时间处理NO2的量与温度关系如图。试说明图中曲线先增大后减小的原因___(假设该温度范围内催化剂的催化效率相同)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用“化学计量在实验中的应用”的相关知识填空。
(1)含有6.02×1023个氧原子的H2SO4的物质的量是_______.
(2)与标准状况下VLCO2所含氧原子数目相同的水的质量是_______g(用分式表示)
(3)将4gNaOH溶解在10mL水中,再稀释成1L,从中取出10mL,这10mL溶液的物质的量浓度为________.
(4)在一定的温度和压强下,1体积X2(g)跟3体积Y2(g)化合生成2体积化合物,则该化合物的化学式是________.
(5)将50mL0.1molL1NaCl和50mL0.5molL1CaCl2溶液混合后,若溶液的体积为二者体积之和,则混合溶液中c(Cl)为_______.
(6)三种正盐的混合溶液中含有0.2molNa+、0.25molMg2+、0.4molCl和SO42,则n(SO42)为_________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数,则下列叙述中正确的是( )
A.同温同压下,NA个NO气体与NA个N2和O2的混合气体的体积相等
B.标准状况下,22.4LCCl4所含分子数为NA
C.4℃时,9mL水和标准状况下11.2L氮气含有相同的原子数
D.1.7gH2O2中含有的电子数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知液氨的性质与水相似。T ℃时,NH3+NH3![]() NH4 ++NH2-,NH4+的平衡浓度为1×10-15 mol·L-1,则下列说法中正确的是( )
NH4 ++NH2-,NH4+的平衡浓度为1×10-15 mol·L-1,则下列说法中正确的是( )
A. 在此温度下液氨的离子积为1×10-14
B. 在液氨中放入金属钠,可生成NaNH2
C. 恒温下,在液氨中加入NH4Cl,可使液氨的离子积减小
D. 降温,可使液氨电离平衡逆向移动,且c(NH4+)<c(NH2-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化镁(Mg3N2)在工业上具有非常广泛的应用。某化学兴趣小组用镁和氮气反应制备Mg3N2并进行有关实验。实验装置如图所示:
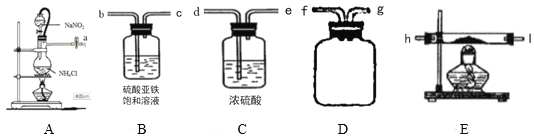
已知:①氮化镁常温下为浅黄色粉末,极易与水反应生成一种有刺激性气味的气体。
②亚硝酸钠和氯化铵制取氮气的反应剧烈放热,产生氮气的速度较快。
③温度较高时,亚硝酸钠会分解产生O2等。
④硫酸亚铁具有还原性,容易被氧化。
回答下列同题:
(1)写出制取N2发生反应的化学方程式___。
(2)实验获置(可重复使用)的连接顺序为:a→___,___→___,___→___,___→h,i→___。
(3)某同学检验A装置的气密性,关闭止水夹K后,开启分液漏斗活塞,水不断往下滴,直至全部流入烧瓶,试判断:A装置是否漏气?___(填“漏气”“不漏气”或“无法确定”)。
(4)装置B中为饱和硫酸亚铁溶液,作用是___。
(5)加热至反应开始发生,需移走A处酒精灯,原因是___。
(6)反应结束后,取m g E中样品于试管中,加足量蒸馏水,有刺激性气味气体产生,再向剩余固体中加稀硫酸,得VmL气体(换算为标准状况),则样品中氮化镁的质量分数为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸亚铁晶体(FeC2O4·2H2O)是一种淡黄色粉末,某课外小组利用下列装置检验草酸亚铁晶体受热分解的部分产物。
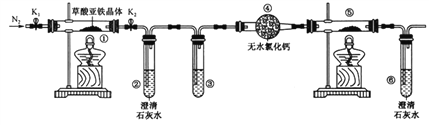
下列说法正确的是
A. 若③和⑤中分别盛放足量NaOH溶液和CuO,可检验生成的CO
B. 实验时只需要在装置①中反应结束后再通入N2
C. 若将④中的无水CaCl2换成无水硫酸铜可检验分解生成的水蒸气
D. 实验结束后,①中淡黄色粉末完全变成黑色,则产物一定为铁
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Bodensteins研究反应H2(g)+I2(g)![]() 2HI(g) △H<0 ,温度为T时,在两个体积均为1L的密闭容器中进行实验,测得气体混合物中碘化氢的物质的量分数w(HI)与反应时间t的关系如下表:
2HI(g) △H<0 ,温度为T时,在两个体积均为1L的密闭容器中进行实验,测得气体混合物中碘化氢的物质的量分数w(HI)与反应时间t的关系如下表:
容器编号 | 起始物质 | t/min | 0 | 20 | 40 | 60 | 80 | 100 |
Ⅰ | 0.5molI2、0.5molH2 | w(HI)/% | 0 | 50 | 68 | 76 | 80 | 80 |
Ⅱ | xmolHI | w(HI)/% | 100 | 91 | 84 | 81 | 80 | 80 |
研究发现上述反应中:v正=kaw(H2)w(I2),v逆=kbw2(HI),其中ka、kb为常数。下列说法不正确的是( )
A. 温度为T时,该反应![]() =64
=64
B. 容器I中在前20min的平均速率v(HI)=0.025molL-1min-1
C. 若起始时,向容器I中加入物质的量均为0.1mol的H2、I2、HI,反应逆向进行
D. 无论x为何值,两容器中达平衡时w(HI)%均相同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com