
| 选项 | 实验操作 | 实验现象 | 结 论 |
| A | 将少量Fe(NO3)2试样加水溶解,滴加稀H2SO4酸化,再滴加KSCN溶液 | 溶液变成红色 | Fe(NO3)2试样已变质 |
| B | 将少量某无色气体通入澄清石灰水 | 出现白色沉淀 | 该气体一定是CO2 |
| C | 分别测定常温下0.1 mol·L-1 Na2SiO3溶液和Na2CO3溶液的pH | pH: Na2SiO3 >Na2CO3 | 非金属性: Si>C |
| D | 向浓度均为0.1 mol·L-1 NaCl和NaI混合溶液中,滴加少量AgNO3溶液 | 出现黄色沉淀 | Ksp(AgCl) >Ksp(AgI) |
 导学教程高中新课标系列答案
导学教程高中新课标系列答案科目:高中化学 来源:不详 题型:单选题
| 选项 | 实验操作 | 现象 | 解释或结论 |
| A | 向溶液X中先滴加稀硝酸,再滴加Ba(NO3)2溶液 | 出现白色沉淀 | 溶液X中一定含有SO42- |
| B | 用铂丝蘸取溶液Y进行焰色反应 | 火焰呈黄色 | 溶液Y中含Na+,不含K+ |
| C | 向一定浓度的Na2SiO3溶液中通入适量CO2气体 | 出现白色沉淀 | H2SiO3的酸性比H2CO3的酸性强 |
| D | 向饱和Na2CO3溶液中通入足量CO2 | 溶液变浑浊 | 析出了NaHCO3 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.丁达尔效应是区分溶液和胶体的一种常用物理方法 |
| B.氯化钠溶液蒸发结晶时,必须将蒸发皿中的液体蒸干才能停止加热 |
| C.实验室可用KOH稀溶液除去NaCl溶液中混有的少量MgCl2杂质 |
| D.测定某溶液的pH,常用干燥洁净的玻璃棒蘸取该溶液滴在润湿的pH试纸上 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| | 实验目的 | 操作 |
| A | 确定碳和硅两元素非金属性强弱 | 测同温同浓度Na2CO3和Na2SiO3水溶液的pH |
| B | 除去苯中混有的苯酚 | 向混合液中加入浓溴水,充分反应后,过滤 |
| C | 证明SO2具有漂白性 | 将SO2通入酸性KMnO4溶液中 |
| D | 证明氯乙烷中含氯元素 | 向氯乙烷中滴几滴AgNO3溶液再滴加稀HNO3 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
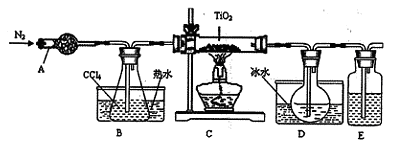
| 物质 | 熔点/℃ | 沸点/℃ | 其它 |
| CCl4 | -23 | 76 | 与 TiCl4互溶 |
| TiCl4 | -25 | 136 | 遇潮湿空气产生白雾 |
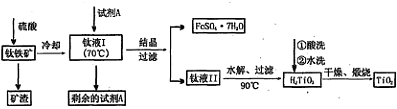
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
A.检验试液中的SO42-:试液 无沉淀 无沉淀 白色沉淀 白色沉淀 |
B.检验试液中的SO32-:试液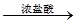 气体 气体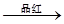 褪色 褪色 |
C.检验试液中的I-:试液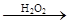 棕黄色溶液 棕黄色溶液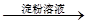 蓝色溶液 蓝色溶液 |
D.检验试液中的CO32-:试液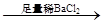 白色沉淀 白色沉淀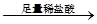 沉淀溶解 沉淀溶解 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.除去Cl2中少量的HCl,可将混合气体通过盛有饱和NaCl溶液的洗气瓶 |
| B.向久置于空气的FeCl2溶液中滴入KSCN溶液,会产生Fe(SCN)3血红色沉淀 |
| C.向某溶液中滴入稀盐酸产生使澄清石灰水变浑浊的气体,该溶液一定含有CO32- |
| D.实验室可采用分液法直接分离乙酸乙酯和乙醇的混合液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com