
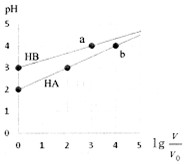
 室温下,浓度均为0.1mol•L-1、体积均为V0HA、HB溶液,分别加水稀释至V,pH随lg$\frac{V}{{V}_{0}}$的变化如图所示,下列说法正确的是( )
室温下,浓度均为0.1mol•L-1、体积均为V0HA、HB溶液,分别加水稀释至V,pH随lg$\frac{V}{{V}_{0}}$的变化如图所示,下列说法正确的是( )| A. | HA为强酸,HB为弱酸 | |
| B. | 水的电离程度a点大于b点 | |
| C. | 当pH=2时,HA溶液中$\frac{c(HA)}{c({A}^{-})}$=9 | |
| D. | 等浓度等体积的HB与Na0H溶液充分反应后,离子浓度关系大小为:c(B-)>c(Na+)>c(H+)>c(OH-) |
分析 A、当lg$\frac{V}{{V}_{0}}$=1,也就是溶液稀释10倍,但PH变化都不到1个单位;
B、两种酸对水的电离都起抑制作用,氢离子的浓度越大水的电离程度越小;
C、当pH=2时,也就是c(H+)=c(A-)=10-2mol/L,而c(HA)=0.1-0.01=0.09mol/L,所以HA溶液中$\frac{c(HA)}{c({A}^{-})}$=9;
D、等浓度等体积的HB与NaOH溶液充分反应后,恰好完全反应生成NaB,B离子是弱离子,水解溶液呈碱性;
解答 解:A、当lg$\frac{V}{{V}_{0}}$=1,也就是溶液稀释10倍,但PH变化都不到1个单位,所以HA和HB都为弱酸,故A错误;
B、两种酸对水的电离都起抑制作用,氢离子的浓度越大水的电离程度越小,而a、b两点氢离子的浓度相同,所以水的电离程度相同,故B错误;
C、当pH=2时,也就是c(H+)=c(A-)=10-2mol/L,而c(HA)=0.1-0.01=0.09mol/L,所以HA溶液中$\frac{c(HA)}{c({A}^{-})}$=9,故C正确;
D、等浓度等体积的HB与NaOH溶液充分反应后,恰好完全反应生成NaB,B离子是弱离子,水解溶液呈碱性,离子浓度关系大小为:c(Na+)>c(B-)>c(OH-)>c(H+),故D错误;
故选C.
点评 本题考查离子浓度大小比较,侧重考查学生分析判断及计算能力,为高频考点,要注意盐的水解在离子浓度大小比较中的应用.


科目:高中化学 来源: 题型:选择题
| A. | 2Na+O2$\frac{\underline{\;点燃\;}}{\;}$Na2O2 | B. | Na2O+H2O═2NaOH | ||
| C. | 2F2+2H2O═4HF+O2 | D. | 2C+SiO2$\frac{\underline{\;高温\;}}{\;}$2CO↑+Si |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该废水中可能含有较多的Fe2+、Fe3+ | |
| B. | 此电解法缺点之一是会产生少量氯气 | |
| C. | 阳极反应式为2CN--10e-+3H2O=CO2↑+N2↑+6H+ | |
| D. | 电解法处理后的废水pH减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
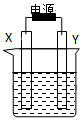 如图装置中X和Y均为石墨电极,电解液为500mL某CuCl2溶液,电解时X电极表面有红色固体生成,Y电极有气体产生.一段时间后,取出X电极,洗涤、干燥、称量,电极增重1.6g.下列有关说法中正确的是( )
如图装置中X和Y均为石墨电极,电解液为500mL某CuCl2溶液,电解时X电极表面有红色固体生成,Y电极有气体产生.一段时间后,取出X电极,洗涤、干燥、称量,电极增重1.6g.下列有关说法中正确的是( )| A. | X电极连接电源正极 | B. | 生成气体体积为0.56L | ||
| C. | Y电极上发生氧化反应 | D. | 该CuCl2溶液浓度为0.05mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | XY2是形成酸雨的主要污染物 | |
| B. | X、Y、R三种元素的非金属性Y>R>X | |
| C. | X、Z分别与R形成的化合物中化学键类型不同 | |
| D. | 含有Y、Z、R三种元素的化合物溶液可能显碱性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷与氯气的物质的量之比为1:1,混合发生取代反应只生成CH3C1 | |
| B. | 甲烷与氯气的取代反应,生成的产物中CH3C1最多 | |
| C. | 甲烷与氯气的取代反应生成的产物为混合物 | |
| D. | 1mo1甲烷生成CCl4最多消耗2mo1氯气 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
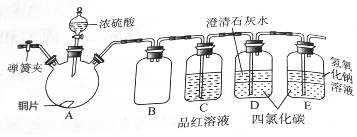 某研究性学习小组为研究Cu与浓硫酸的反应,设计如下实验探究方案(装置中的固定仪器和酒精灯均未画出).
某研究性学习小组为研究Cu与浓硫酸的反应,设计如下实验探究方案(装置中的固定仪器和酒精灯均未画出).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=3的草酸溶液含有H+数目为0.001NA | |
| B. | 当1molKMnO4被还原时强酸提供H+数目为NA | |
| C. | 1molHOOC-COOH含共用电子对数目为9NA | |
| D. | 该反应释放CO2分子数目为$\frac{V}{22.4}$NA |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖南省高一上第一次月考化学试卷(解析版) 题型:选择题
关于容量瓶的四种叙述:①是配制准确浓度溶液的仪器;②不宜贮存溶液;③不能用来加热;④使用之前要检查是否漏水。这些叙述中正确的是( )
A. ①②③④ B. ②③ C. ①②④ D. ②③④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com