
【题目】下列各组热化学方程式中,化学反应的ΔH前者大于后者的是( )
①C(s)+O2(g)===CO2(g) ΔH1 C(s)+1/2O2(g)===CO(g) ΔH2
②S(s)+O2(g)===SO2(g) ΔH3 S(g)+O2(g)===SO2(g) ΔH4
③H2(g)+1/2O2(g)===H2O(l) ΔH5 2H2(g)+O2(g)===2H2O(l) ΔH6
④CaCO3(s)===CaO(s)+CO2(g) ΔH7 CaO(s)+H2O(l)===Ca(OH)2(s) ΔH8
A.① B.④ C.②③④ D.①②③
科目:高中化学 来源: 题型:
【题目】在密闭容器中的一定量混合气体发生反应:x A(g) + yB(g) ![]() z C(g),平衡时测得A的浓度为0.50mol/L,保持温度不变,将容器的容积扩大到原来的2倍,再达平衡时,测得A的浓度为0.30mol/L。下列有关判断正确的是( )
z C(g),平衡时测得A的浓度为0.50mol/L,保持温度不变,将容器的容积扩大到原来的2倍,再达平衡时,测得A的浓度为0.30mol/L。下列有关判断正确的是( )
A. x+y>z B. 平衡向正反应方向移动 C. B的转化率升高 D. C的体积分数增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.镓(Ga)位于周期表的第四周期,与Al同主族,主要存在Ga3+、GaO2-两种离子形式,被广泛应用于电子工业。
(1)用铝粉和Fe2O3做铝热反应实验,需要的试剂还有__________________。
a.KClO3 b. KCl c. MnO2 d. Mg
(2)半导体材料氮化镓由Ga与NH3在一定条件下发生置换反应生成。该过程每生成1molGaN(s)放出热量15.4kJ。镓在周期表中的序号_____________,写出该反应的热化学方程式_________________。
(3)工业上用电解法精炼镓。具体原理如图所示,已知:金属的活动性Zn>Ga>Fe>Cu

①电解精炼镓一段时间后形成的阳极泥主要有______________
②已知精炼时阴极反应:GaO2-+3e-+2H2O=Ga+4OH- 。阳极的电极反应方程式:___________________________________;
Ⅱ.用废铁皮制取铁红(Fe2O3)的部分流程示意图如下:

(4)步骤I温度不能过高。因为:_______________________________。
(5)步骤II中发生反应4Fe(NO3)2+O2+(2n+4)H2O=2Fe2O3·nH2O+8HNO3,生成的硝酸又将废铁皮中的铁转化为Fe(NO3)2。
写出后者反应的离子方程式______________________________________。
(6)上述生产流程中,能体现“绿色化学”思想的是______________________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
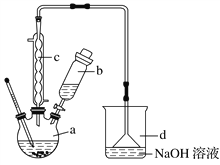
【题目】溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如下:
苯 | 溴 | 溴苯 | |
密度/g·cm-3 | 0.88 | 3.10 | 1.50 |
沸点/℃ | 80 | 59 | 156 |
水中溶解度 | 微溶 | 微溶 | 微溶 |
按下列合成步骤回答问题:
(1)在a中加入15 mL无水苯和少量铁屑。在b中小心加入4.0 mL液态溴。向a中滴入几滴溴,有白色烟雾产生,是因为生成了________气体;继续滴加至液溴滴完;装置d的作用是________________。
(2)液溴滴完后,经过下列步骤分离提纯:
①向a中加入10 mL水,然后过滤除去未反应的铁屑;
②滤液依次用10 mL水、8 mL 10%的NaOH溶液、10 mL水洗涤。NaOH溶液洗涤的作用是_______________________________________________________;
③向分出的粗溴苯中加入少量的无水氯化钙,静置、过滤。加入氯化钙的目的是____________________________________________ 。
(3)经以上分离操作后,粗溴苯中还含有的主要杂质为______,要进一步提纯,下列操作中可行的是________(填字母)。
A.重结晶 B.过滤
C.蒸馏 D.萃取
(4)在该实验中,a的容积最适合的是________(填字母)。
A.25 mL B.50 mL
C.250 mL D.500 mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列热化学方程式书写正确的是
A. 已知甲烷的燃烧热为890.3 kJmol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH=-890.3 kJmol-1
B. 已知强酸和强碱的稀溶液反应的中和热为57.3 kJmol-1,则CH3COOH+OH—=CH3COO—+H2O ΔH=-57.3 kJmol-1
C. 一定条件下,将0.5mol N2和1.5mol H2置于密闭容器中,充分反应生成NH3(g),放出热量19.3kJ,其热化学方程式为:N2(g)+3H2(g)![]() 2NH3(g) ΔH=-38.6 kJmol-1
2NH3(g) ΔH=-38.6 kJmol-1
D. 已知1g N2H4(l)和足量H2O2(l)反应生成氮气和水蒸气,放出热量20.05kJ,该热化学方程式可表示为:N2H4(l)+2H2O2(l)=N2(g)+4H2O(g) ΔH=-641.6 kJmol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于下列四个图象的说法中不正确的是
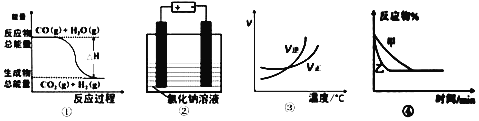
A. 图①可表示可逆反应:CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH<0
CO2(g)+H2(g) ΔH<0
B. 图②表示用惰性电极电解足量氯化钠溶液时,两极产生的气体物质的量相等
C. 图③可表示可逆反应:A2(g)+3B2(g)![]() 2AB3(g) ΔH >0
2AB3(g) ΔH >0
D. 图④可表示压强对可逆反应:2A(g)+B(g)![]() 3C(g)+D(s)的影响,且乙压强大
3C(g)+D(s)的影响,且乙压强大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锂-空气电池是一种新型的二次电池,由于具有较高的比能量而成为未来电动汽车的希望。其放电时的工作原理如图所示。下列说法正确的是
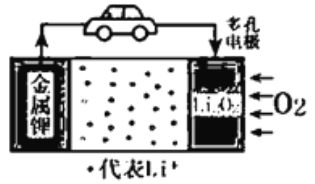
A. 该电池放电时,锂电极发生了还原反应
B. 放电时,Li+向锂电极迁移
C. 电池中的电解液可以是有机电解液或稀盐酸等
D. 充电时,电池正极的反应式为Li2O2-2e-=2Li++O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA表示阿伏加德罗常数的值,下列叙述正确的是( )
A. 等物质的量的N2和CO所含分子数均为NA
B. 常温下,0.1molCuSO4·5H2O晶体中氧原子数目为0.4 NA
C. NA个N2分子所占的体积与0.5NA个H2分子所占的体积比为2∶1
D. 常温下,1L 0.1mol·L-1的NH4NO3溶液中氮原子数为0.2NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com