
【题目】关于化合物![]() (b)、
(b)、![]() (d)、
(d)、![]() (p)的下列说法正确的是
(p)的下列说法正确的是
A. b、d、p都属于芳香烃,且互为同分异构体
B. b、d、p的一氯代物均只有三种
C. b、d、p均可与溴的四氯化碳溶液反应
D. b、d、p中b、d的所有原子可能处于同一平面
 学习实践园地系列答案
学习实践园地系列答案科目:高中化学 来源: 题型:
【题目】常温下,几种物质的溶度积常数见下表:
物质 | Cu(OH)2 | Fe(OH)3 | CuCl | CuI |
Ksp | 2.2×10-20 | 2.6×10-39 | 1.7×10-7 | 1.3×10-12 |
(1)某酸性CuCl2溶液中含少量的FeCl3,为制得纯净CuCl2溶液,宜加入__________,将溶液调至pH=4,使Fe3+转化为Fe(OH)3沉淀,此时溶液中的c(Fe3+)=____________________ mol·L-1。
(2)上述溶液过滤后,将所得滤液经过________、________(按操作顺序填写实验步骤的名称),再经过滤,可得到CuCl2·2H2O晶体。
(3)某学习小组用“间接碘量法”测定含有CuCl2·2H2O晶体的试样(不含能与I-发生反应的氧化性杂质)的纯度,过程如下:取0.800 g试样溶于水,加入适当过量的KI固体,充分反应,生成白色沉淀。用0.100 0 mol·L-1Na2S2O3标准溶液滴定,到达滴定终点时,消耗Na2S2O3标准溶液40.00 mL(已知:I2+2S2O![]() ===S4O
===S4O![]() +2I- )。
+2I- )。
①可选用________作滴定指示剂,滴定终点的现象是______________________。
②CuCl2溶液与KI反应的离子方程式为________________________________。
③含有CuCl2·2H2O晶体的试样的纯度是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】配合物Fe(CO)5的熔点一20℃,沸点103℃。可用于制备纯铁。Fe(CO)5的结构如图所示。

(1)基态Fe原子的价电子排布式是_____________________;Fe(CO)5晶体类型属于__________晶体。
(2)CO分子中C、O原子都满足8电子稳定结构,CO分子的结构式是________,写出与CO互为等电子体的分子的电子式:___________________。
(3)C、O、Fe的第一电离能由大到小的顺序为_______________________。
(4)关于Fe(CO)5,下列说法正确的是______。
A. Fe(CO)5是非极性分子,CO是极性分子 B. Fe(CO)5中Fe原子以sp3杂化方式与CO成键
C.1molFe(CO)5含有10mol配位键 D.Fe(CO)5==Fe+5CO反应中没有新化学键生成
(5)铁的三种晶体的晶胞均为立方晶胞,三种晶体的晶胞如下图所示。

①上述三种晶体的晶胞中属于面心晶胞的是______(填“a”“δ””或“γ”)-Fe。
②a-Fe晶胞中铁原子的配位数为_______________。
③γ-Fe晶胞的边长为apm,则γ-Fe单质的密度为____g/cm3(NA表示阿伏伽德罗常数的值,列出计算式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容。

(1)硫酸具有A-D所示的性质,以下过程主要表现了浓硫酸的那些性质?请将选项字母填在下列各小题的横线上:
A强酸性 B 吸水性 C 脱水性 D 强氧化性
①浓硫酸可以干燥氢气__________
②浓硫酸使木条变黑__________
③热的浓硫酸与铜片反应__________
(2)现用该浓硫酸配制100mL 1mol/L的稀硫酸。可供选用的仪器有:①胶头滴管;②烧瓶;③烧杯;④药匙;⑤量筒;⑥托盘天平。请回答下列问题:
(i)配制稀硫酸时,上述仪器中不需要使用的有__________(选填序号),还缺少的仪器有__________(写仪器名称);
(ii)经计算,配制100mL1mol/L的稀硫酸需要用量筒量取上述浓硫酸的体积为__________mL(保留一位小数),
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇可作为燃料电池的原料。通过下列反应可以制备甲醇:CO ( g ) + 2H2( g )CH3OH ( g ) △H=-90.8 kJ·mol-1在一容积可变的密闭容器中充入10 mol CO 和20 molH2,CO 的平衡转化率随温度(T)、压强(P)的变化如图所示,当达到平衡状态A时,容器的体积为20 L。
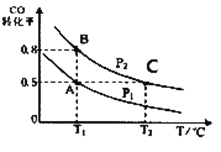
(1)该反应的化学平衡常数表达式为_____________。
(2)图中正反应速率:ν(A)___ν(B);平衡常数: K(A)_____K(C);平均摩尔质量:M(B)_____M(C)(填“>”、“<”或“=”)。
(3)关于反应CO(g)+2H2(g) CH3OH(g)在化学平衡状态时的描述正确的是_______(填字母)。
A.CO的含量保持不变
B.2V正(CH3OH)=V正(H2)
C.容器中CH3OH浓度与CO浓度相等
D.容器中混合气体的密度保持不变
(4)如反应开始时仍充入10mol CO 和20mol H2,则在平衡状态B时容器的体积V(B)为__________L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国明代《本草纲目》中“烧酒”条目下写道:“自元时始创其法,用浓酒和糟入甑,蒸令气上…其清如水,味极浓烈,盖酒露也。”这里所用的“法”是指( )
A.萃取B.洗气C.蒸馏D.干馏
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列哪一实例能说明微量元素是生命活动所必需的( )
A.Mg是叶绿素不可缺少组成成分
B.哺乳动物血液中Ca2+盐含量太低会抽搐
C.油菜缺少B时只开花不结果
D.人体内Mn的含量过高会导致运动失调
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、X 均为中学常见的单质或化合物,它们之间有如下转化关系(副产物已略去)。 试回答:
![]()
(1)若 X 是气体单质,则 A 可能是_____.
a.C b.Al c.Na d.Fe
(2)若 X 是金属单质,向 C 的水溶液中滴加 AgNO3 溶液,产生不溶于稀 HNO3 的白色沉淀;X 在 A
中可以燃烧。
①B 的化学式为_____;C 溶液在贮存时应加入少量 X,理由是(用必要的文字和离子方程式 表示)_________。
②向 C 的溶液中加入氢氧化钠溶液,现象是_________;写出涉及到的氧化还原反应的 化学方程式_____。
(3)若 A、B、C 为含有同种金属元素的化合物,X 为强酸或强碱溶液,则 B 的化学式为_____; 反应②的离子方程式为__________________或________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com