
| A. | 质谱法是快速、微量、精确测定相对分子质量的方法 | |
| B. | 红外光谱仪不可用于测定化合物的官能团 | |
| C. | 用核磁共振氢谱鉴别1-溴丙烷和2-溴丙烷 | |
| D. | 氯溴碘代甲烷存在同分异构体 |
分析 A.质谱法可获取有机物的质荷比,最大质荷比等于相对分子质量;
B.红外光谱仪用于测定有机物的中的官能团;
C.1-溴丙烷和2-溴丙烷的氢原子种类不同;
D.氯溴碘代甲烷是手性分子.
解答 解:A.质谱仪其实是把有机物打成很多小块,会有很多不同的分子量出现,其中最大的那个就是该有机物的分子量,故A正确;
B.红外光谱仪用于测定有机物的中的官能团,不同的共价键或官能团的光谱波长不同,故B错误;
C.1-溴丙烷和2-溴丙烷的氢原子种类不同,用核磁共振氢谱鉴别氢原子的峰面积和种类不同,可鉴别,故C正确;
D.氯溴碘代甲烷是手性分子,存在镜像异构,故D正确.
故选B.
点评 本题综合考查有机物的结构和性质,为高频考点,侧重于学生的分析能力的考查,注意把握有机物的结构的测定方法,难度不大.


 智趣暑假温故知新系列答案
智趣暑假温故知新系列答案 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案科目:高中化学 来源: 题型:解答题
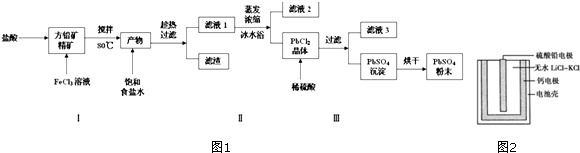
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
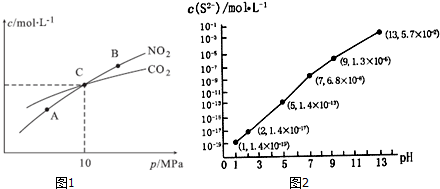
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
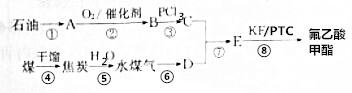
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 升高温度,该反应的平衡常数将增大 | |
| B. | 从平衡混合气中分离出水蒸气可提高CO2和H2的利用率 | |
| C. | 再向该容器中充入2 mol H2和1 mol CO2,达到平衡时,H2的转化率将小于CO2 | |
| D. | T℃,在起始体积为V L的密闭容器(容积可变,恒压)中将3 mol H2和1 mol CO2混合,达到平衡时乙醇体积分数大于a |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
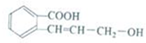
| A. | 该有机化合物分子式为C10H10O3 | |
| B. | 1mol该有机化合物最多可与2molNaOH发生中和反应 | |
| C. | 该有机化合物中两种官能团之间可以发生酯化反应 | |
| D. | 该有机化合物和乙烯均能使酸性高锰酸钾溶液褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二氧化硫有毒,严禁将其添加到任何食品和饮料中 | |
| B. | “氟化物防治龋齿”是应用了沉淀转化的原理,产生更能抵抗酸侵蚀的物质 | |
| C. | 使用增塑剂-邻苯二甲酸酯可使聚氯乙烯由弹性塑胶变为硬塑胶 | |
| D. | 面粉生产中禁止添加的过氧化钙(CaO2)中阴阳离子的个数比为1:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①⑤⑥⑧ | B. | ①③⑥⑧ | C. | ③⑤⑥⑦ | D. | ②④⑦⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| X | ||||
| Y | Z | T | ||
| W |
| A. | TX2、T2或X3均可用于做杀菌消毒 | |
| B. | W元素的单质溶于水和汽化都只破坏了分子间作用力 | |
| C. | 元素T的非金属性比W强,所以HT的酸性比HW的酸性强 | |
| D. | YT3在常压、178℃时升华,所以YT3中只含有离子键,而ZT4中只含有共价键 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com